领域前沿·中国
ELL3结合的LINE-1作为增强子调控小鼠胚胎干细胞原始多能性
方海同 罗卓娟* 林承棋*
(东南大学, 生命科学与技术学院, 发育与疾病相关基因教育部重点实验室, 南京 210096)
 | 林承棋, 东南大学二级教授、青年首席教授、博士生导师。中组部海外高层次人才引进计划青年项目获得者, 国家重点研发计划项目首席科学家, 科技部中青年科技创新领军人才获得者, 国家万人计划获得者。主要研究方向: (1) 基因表达调控机制; (2) 细胞命运决定与早期胚胎发育调控。在Cell、Nat Cell Biol、Mol Cell、Cell Death Differ、Genes Dev、Sci Adv等杂志上发表SCI论文30余篇,文章被引用4 000余次。曾获新加坡国家医学研究理事会(NMRC)转化与临床研究、新加坡卫生部物医药研究理事会(BMRC)项目、江苏省杰出青年基金、江苏省“双创人才“等多项基金资助。 |
ELL3结合的LINE-1作为增强子调控小鼠胚胎干细胞原始多能性
方海同 罗卓娟* 林承棋*
(东南大学, 生命科学与技术学院, 发育与疾病相关基因教育部重点实验室, 南京 210096)
【摘要】逆转录转座子占据了小鼠基因组的40%以上, 并对宿主基因组的结构和进化产生重要影响。LINE-1是一类具有自主转座能力的逆转录转座子。尽管存在导致基因组不稳定的潜在风险,但LINE-1在胚胎早期阶段高度活化。该团队发现ELL3结合的年轻LINE-1亚家族, L1Md_Ts, 在小鼠原始态胚胎干细胞中起到增强子的作用。当ELL3缺失时, L1Md_Ts 5hmC水平下降, H3K27ac水平上升, 并促使L1Md_Ts附近的基因表达上调。特别是, ELL3结合并抑制了位于Akt3基因内的基于L1Md_T的增强子活性, 而Akt3基因编码了AKT信号通路的关键调控因子。在小鼠胚胎干细胞和着床前胚胎发育过程中, ELL3通过抑制AKT3来调控ERK信号通路的适当激活。该研究揭示了ELL3介导的L1Md_T增强子活性在胚胎干细胞多能性调控中的重要意义。
【关键词】 ELL3; LINE-1; AKT3; 原始态胚胎干细胞
ELL3 Marked LINE-1 Serve as Enhancers to Regulate Naïve Pluripotency in Mouse ESC
FANG Haitong, LUO Zhuojuan*, LIN Chengqi*
(Key Laboratory of Developmental Genes and Human Disease, School of Life Science and Technology, Southeast University, Nanjing 210096, China)
【Abstract】 Retrotransposons make up more than 40% of the mouse genome and have a significant impacton the evolution and structure of the host genome. LINE-1s are a major group of retrotransposons that have theability to autonomously transpose. Despite the potential for gene toxicity, LINE-1s are highly activated during the early stages of embryo development. In the study, LIN and colleagues have identified a subset of youngLINE-1s, called L1Md_Ts, that are marked by ELL3 and function as enhancers in naïve mouse ESCs (embryonicstem cells). Depletion of ELL3 results in a loss of 5hmC, an increase in H3K27ac, and an up-regulation of genesnear the L1Md_Ts. Specifically, ELL3 occupies and represses an enhancer within Akt3, which is a key regulatorof the AKT pathway. ELL3 is essential for proper ERK activation in both mouse ESC and pre-implantation embryos. This study reveals the significance of ELL3 in governing the enhancer function of L1Md_Ts in the regulation of pluripotency in ESC.
【Keywords】ELL3; LINE-1; AKT3; naïve embryonic stem cells
1 LINE-1与基因顺式调控
哺乳动物基因组约有一半是由重复元件构成的, 其中超过95%是逆转录转座子, 它们通过转录复制粘贴机制进行“跳跃”[1-2]。逆转录转座子的转座活性尽管可能对宿主基因组有害, 但它们也是进化的驱动力, 并且现在逆转录转座子被认为是宿主基因组的一个不可或缺的组成部分, 具有调控功能[3-4]。大多数逆转录转座子经过长期演化已丧失转座活性。然而, 最近进化的长散在重复元件-1(long interspersed nuclear element-1, LINE-1)是哺乳动物中仍然具有自主迁移能力的逆转录转座子类群[5-7]。在早期胚胎发育过程中, 表观遗传的广泛重编程导致了LINE-1转录的瞬时且显著的增加[8]。尽管LINE-1在着床前胚胎中具有显著的转录活性, 但其逆转录频率却远远低于预期。最近的研究表明, LINE-1转录或其转录产物的调控功能已经超越了其在宿主基因组中的转座作用。例如, LINE-1转录对小鼠早期胚胎中染色质的全局性开放起到重要作用[9]。此外, 研究还发现, LINE-1转录物能够招募核仁蛋白和KAP1来抑制2细胞(2C)胚胎特异性转录因子DUX, 并调控基因组的空间组织[10-11]。虽然大量LINE-1存在于宿主基因附近或相邻区域, 但LINE-1元件本身是否在胚胎发育及基因表达调控中发挥作用目前尚不清楚。
在早期胚胎发育过程中 , 逆转录转座子受到严格的表观遗传调控。Krüppel样锌指蛋白(KRABzinc finger protein, KZFP)和相关的组蛋白修饰酶(如 SETDB1)以及支架蛋白 KAP1能够特异地定向到逆转录转座子(包括古老LINE-1元件)上, 以保持染色质的紧密折叠, DNA对转录因子和RNA聚合酶的不可及性[12-13]。然而, 在小鼠胚胎干细胞(mouseembryonic stem cell, mESC)中, 年轻的LINE-1逃脱了KZFP介导的沉默调控, 受到共抑制子SIN3A和DNA羟甲基化酶TET1的调控, 处于转录静息状态[12-13]。研究发现, Krüppel样锌指转录因子ZFP281可以招募TET1和SIN3A到一部分年轻LINE-1上[14]。年轻LINE-1的表达在胚胎着床前阶段达到最高水平[15],然而, 在早期胚胎发育和干细胞多能性调控过程中,年轻LINE-1如何受到精确调控仍不清楚。
2 ELL3抑制L1Md_T及其附近基因
我们之前的研究表明 , 在血清 /LIF培养的mESC中, ELL3结合在增强子上, 并且调控RNA聚合酶Pol II在发育关键基因启动子上的近端结合[17]。通过ChIP-seq实验, 我们发现ELL3在染色质上的结合位点有3 428个, 大部分位于重复元件区域, 特别是L1Md_T元件占比达到85%(图1A)。为了进一步验证 ELL3对定位的重复元件的调控作用 , 我们在ESC中敲除(KO)了Ell3基因, 并使用RNA-seq方法对细胞进行了分析。结果显示, 在Ell3基因敲除后,L1Md_T的转录水平显著增加(图1B)。同时, 我们还分析了ELL3结合的L1Md_T和L1Md_Gf附近(<50Kb)基因的表达水平, 发现在Ell3基因敲除后, 这些基因的表达水平显著增加(图1C)。KEGG通路分析显示, 这些基因显著富集于AKT、RAS和MAPK信号途径中(图1D)。同时, 我们观察到, ELL3结合在Xlr基因簇内的L1Md_T元件上, Ell3基因敲除会导致该簇内所有Xlr基因的表达上调(图1E)。这些结果提示 ELL3可能通过靶向抑制 L1Md_T来抑制邻近基因的转录活性。
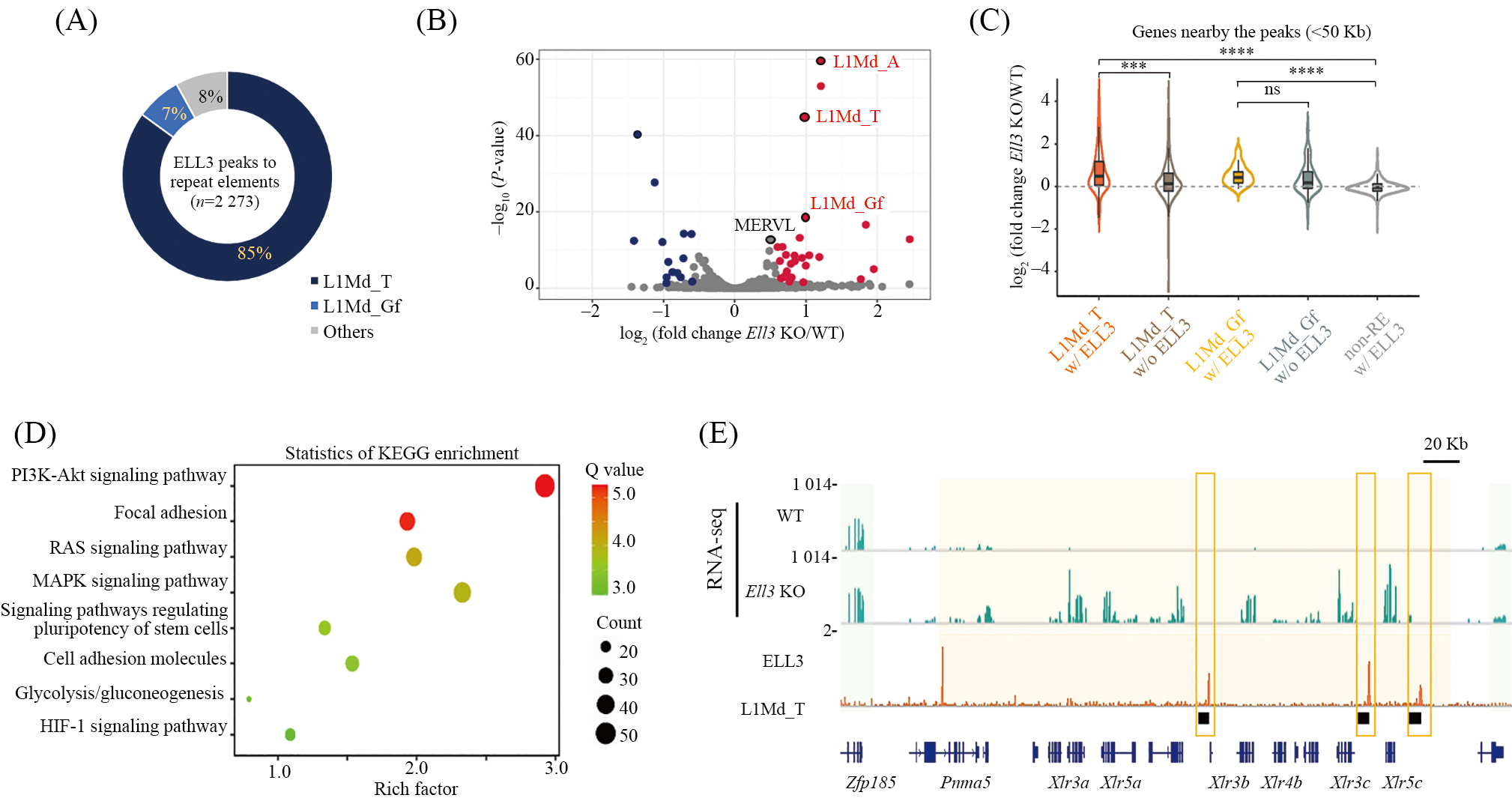 A: 饼图显示ELL3结合的重复元件中L1Md_T和L1Md_Gf的百分比。B: 火山图显示Ell3 KO后差异表达的逆转录重复元件。红色和蓝色点分别代表表达水平显著增加或减少的重复元件(倍数≥1.5或≤−1.5, 且P<0.05)。C: 小提琴图显示Ell3 KO后, ELL3结合的L1Md_T和L1Md_Gf附近50 Kb内基因的表达变化倍数, ELL3未结合的全长L1Md_T和L1Md_Gf基因的表达变化倍数, 以及ELL3结合的非逆转录重复元件(non-REs)的表达变化倍数。D: Ell3 KO后差异表达基因的KEGG通路分析。E: RNA-seq IGV显示WT和Ell3 KO mESC中Xlr家族基因的RNA水平。ChIP-seqIGV显示ELL3在Xlr基因组中的定位。
A: 饼图显示ELL3结合的重复元件中L1Md_T和L1Md_Gf的百分比。B: 火山图显示Ell3 KO后差异表达的逆转录重复元件。红色和蓝色点分别代表表达水平显著增加或减少的重复元件(倍数≥1.5或≤−1.5, 且P<0.05)。C: 小提琴图显示Ell3 KO后, ELL3结合的L1Md_T和L1Md_Gf附近50 Kb内基因的表达变化倍数, ELL3未结合的全长L1Md_T和L1Md_Gf基因的表达变化倍数, 以及ELL3结合的非逆转录重复元件(non-REs)的表达变化倍数。D: Ell3 KO后差异表达基因的KEGG通路分析。E: RNA-seq IGV显示WT和Ell3 KO mESC中Xlr家族基因的RNA水平。ChIP-seqIGV显示ELL3在Xlr基因组中的定位。
A: pie chart showing the percentage of L1Md_T and L1Md_Gf overlapping with ELL3 peaks. B: volcano plot of differentially expressed retrotransposons after Ell3 KO with red dots representing upregulated retrotransposons (FC≥1.5; P<0.05) and blue dots representing downregulated retrotransposons (FC≤–1.5; P<0.05). C: violin plot showing the expression FCs of the genes nearby the ELL3 bound L1Md_Ts and L1Md_Gfs, the ELL3 free fulllength L1Md_Ts and L1Md_Gfs, and the ELL3 bound non-retrotransposons (non-REs) after Ell3 KO (within 50 Kb). The horizontal line across the boxrepresents the median value. D: KEGG pathway enrichment analysis for the genes differentially expressed after Ell3 KO. E: IGV browser tracks showing the RNA-seq signals of RNAs from the Xlr family genes in WT and Ell3 KO mESC. IGV browser tracks showing the ChIP-seq tracks for ELL3 atthe entire Xlr locus.
图1 ELL3通过直接与L1Md_T结合来抑制L1Md_T及其附近的基因(数据修改自参考文献[16])
Fig.1 ELL3 directly binds to the L1Md_T, resulting in the repression of both L1Md_T and the adjacent genes(modified from reference [16])
3 ELL3靶向的L1Md_T作为顺式作用元件调控基因表达
接下来, 我们进一步研究了ELL3调控L1Md_T附近基因表达的调控机制。为了验证 LINE-1是否作为顺式作用元件来调控基因表达, 我们进行了位点特异性CRISPR激活(CRISPRa)实验来特异性激活Ell3在Akt3上的结合位点Akt3_L1(图2A和图2B)。实验结果显示, HA标记的dCas9-VP64能够特异性地定向到Akt3_L1位点, 而不定向到ELL3结合的其他L1Md_T位点(图2C)。进一步的分析发现, Akt3_L1的位点特异性CRISPRa导致H3K27ac在Akt3_L1上的富集程度显著增加(图2D)。在Akt3_L1 CRISPRa细胞系中, L1Md_T的转录水平升高的同时, Akt3表达也上调, 而Xlr5a、Aldh1a2或Reg2的RNA水平没有明显变化 (图 2E)。这些结果表明 , ELL3结合的L1Md_T可能通过顺式作用来调节附近基因的表达。进一步的研究中, 我们分析了mESC Micro-C数据, 并进行了可视化4C分析, 结果显示, ELL3结合的L1Md_T与相邻基因如Akt3、Aldh1a2等发生相互作用(图2F)。通过4C实验验证了Aldh1a2启动子与其最近的L1Md_T之间的相互作用, 并且在Ell3敲除后观察到更强的相互作用(图2G)。这些结果表明,ELL3结合的L1Md_T可作为增强子与邻近基因相互作用, 进而调控其转录活性。
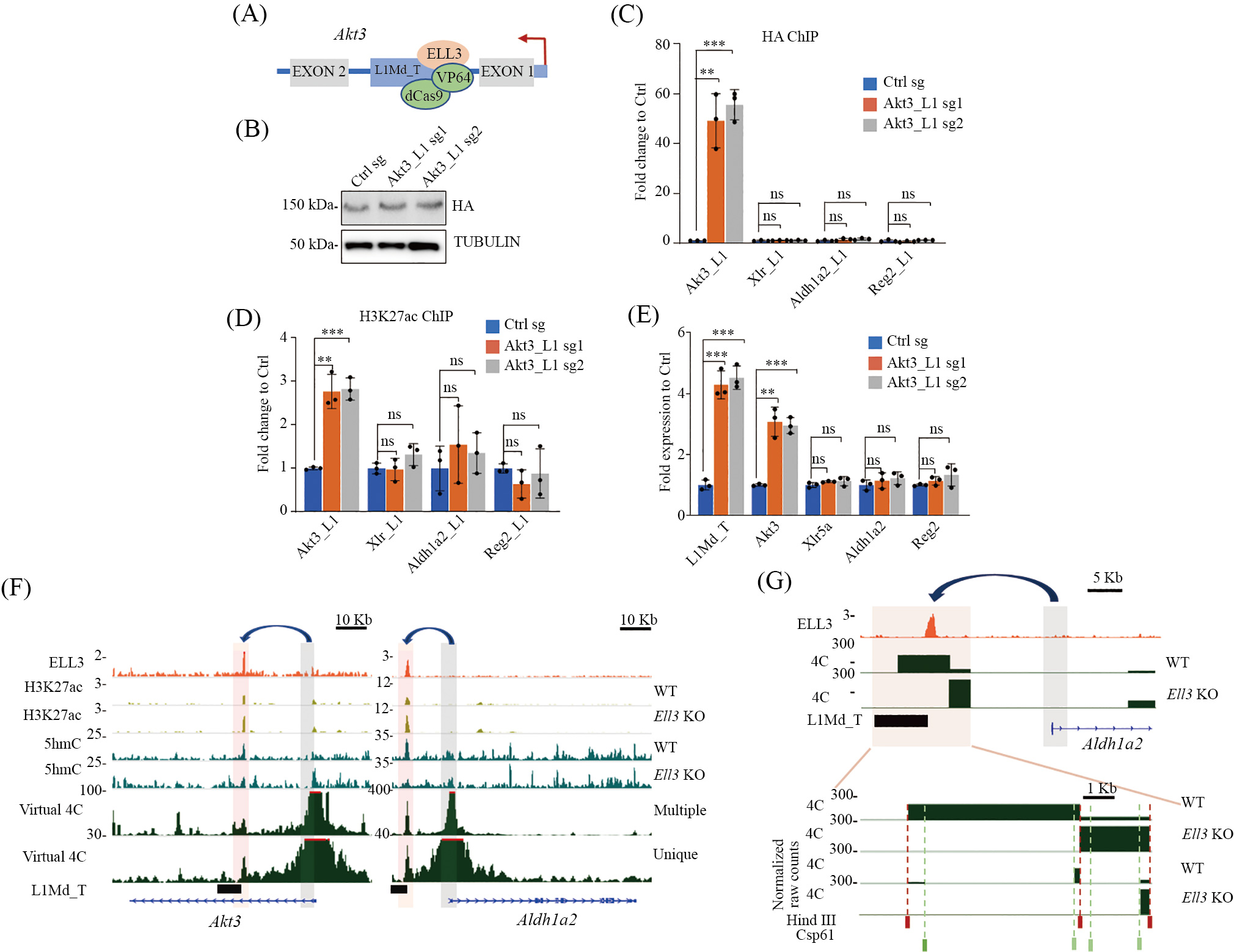
A: dCas9-VP64特异性靶向Akt3_L1并激活Akt3基因示意图。B: Western blot分析显示在CRISPRa载体慢病毒感染mESC后, WB检测到带有HA标签的VP64。C: HA ChIP-qPCR显示特异sgRNA可以引导带有HA标签的VP64定位结合Akt3_L1。D: H3K27ac ChIP-qPCR显示在Akt3_L1 CRISPRa后, Akt3_L1上H3K27ac富集水平增加, 但Xlr_L1、Aldh1a2_L1或Reg2_L1上没有显著变化。E: RT-qPCR显示在Akt3_L1 CRISPRa后, L1Md_T和Akt3的RNA水平上调, 但Xlr5a、Aldh1a2或Reg2没有明显变化。B~E, 数据为3次独立实验的平均值±SEM, 并进行了t检验。**P<0.01,***P<0.001, ns=不显著。F: ChIP-seq可视化显示Ell3 KO后Akt3_L1和Aldh1a2_L1上H3K27ac富集水平增加, hMeDIP-seq可视化显示5hmC水平降低。虚拟4C分析的结果表明, Akt3和Aldh1a2的启动子分别与Akt3_L1和Aldh1a2_L1发生相互作用。蓝色条表示视点, 橙色条表示推测的增强子区域。显示来自多映射和唯一映射的reads。G: 可视化显示Aldh1a2基因上的ELL3 ChIP-seq和4C数据。放大图示意4C信号中Hind III片段末端的计数映射。数据进行了多映射reads的分析。
A: schematic of Akt3 gene activation by dCas9-VP64 targeting the Akt3_L1 specifically. B: Western blot analysis for HA-VP64 can be detected inmESC after lentiviral transduction of the dCas9-VP64 vectors. C: HA ChIP-qPCR demonstrates that specific sgRNA can guide HA-tagged VP64 totarget and bind Akt3_L1. D: H3K27ac ChIP-qPCR at Akt3_L1, Xlr_L1, Aldh1a2_L1 and Reg2_L1 after Akt3_L1 CRISPRa. E: RT-qPCR showing theRNA levels of L1Md_T, Akt3, Xlr5a, Aldh1a2 and Reg2 after Akt3_L1 CRISPRa. B-E: data are the mean±SEM from three independent experiments. ttests were performed. **P<0.01, ***P<0.001, ns=not significant. F: IGV browser shows ChIP-seq signal tracks for H3K27ac and hMeDIP-seq signaltracks at Akt3_L1 and Aldh1a2_L1. Multi-mapped reads were used for the analyses. A zoom-in view from the virtual-4C showing the interaction ofpromoters of Akt3 and Aldh1a2 to Akt3_L1 and Aldh1a2_L1, respectively. Blue bars indicating the view points, and orange bars indicating the putativeenhancer regions. G: browser view of ELL3 ChIP-seq and 4C data at Aldh1a2, bins on 4C corresponding to Hind III fragments. Multi-mapped readswere used for the analyses.
图2 在原始态mESC中ELL3结合的L1Md_T具有增强子活性(数据修改自参考文献[16])
Fig.2 The ELL3-regulated L1Md_T serve as enhancers in naïve mESC (modified from reference [16])
4 ELL3-AKT3-ERK调控轴调控干细胞多能性和早期胚胎发育
已有研究表明 , AKT可以在癌症中磷酸化RAF的S259, 并抑制RAF-MEK-ERK通路[18]。为了验证 AKT3上调是否改变原始态 mESC中的 RAFMEK-ERK通路活性 , 我们在不加 MEK/ERK抑制剂PD0325901的培养基中进行mESC培养。结果显示, Ell3 KO mESC中AKT3蛋白以及磷酸化AKT(pAKT1/2/3)水平显著增加, 而p-ERK1/2显著减少(图3A)。这提示Ell3 KO后高水平的AKT3对ERK的磷酸化可能具有抑制作用。为了进一步验证这一观察结果, 我们使用两个独立的shRNA在Ell3 KO细胞中进行Akt3敲低(KD), Western blot结果显示, Akt3 KD可部分恢复RAF S259和p-ERK1/2水平(图3A)。以上结果说明, Ell3 KO导致AKT3转录激活, 进而抑制ERK磷酸化。
原始态mESC中的ERK处于去磷酸化状态, 而ERK的磷酸化对推动ESC从原始态向始发态的转化至关重要。考虑到ELL3可通过抑制AKT3来促进ERK的磷酸化, 我们进一步探究了ELL3在调节ESC从原始态向始发态的转化中的作用。在FA培养基(Fgf2+ActivinA)中培养ESC, 可诱导细胞从原始态向始发态转变。转录组分析显示Ell3 KO阻碍了一些始发态ESC标志基因(如Pitx2和Grb10)的激活,同时也显著抑制了原始态标志基因(包括Nanog和Esrrb)在原始态向始发态转化过程中的下调(图3B)。这些结果表明ELL3在调控ESC多能性转化过程中发挥重要作用。
信号转导调节在早期胚胎发育中发挥至关重要的作用[19]。研究发现, AKT信号通路及L1Md_T大约在2细胞(2C)胚胎发育阶段被激活, 而阻断AKT信号通路则会导致早期胚胎发育停滞 [20-21]。这提示ELL3可能通过抑制L1Md_T和AKT3来调节着床前胚胎的 ERK活性 , 参与调控早期胚胎发育。我们分析多种哺乳动物早期胚胎的单细胞RNA测序(scRNA-seq)数据发现, ELL3在不同哺乳动物(人类、恒河猴、小鼠)的合子基因组激活(ZGA)阶段被激活表达(图3C和图3D)。早期胚胎免疫染色结果也显示, 从2C阶段开始胚胎中已有ELL3蛋白的表达(图3E)。为了验证早期胚胎中这些基因的表达是否受ELL3调控, 我们向受精卵注射Ell3的特异性siRNA并进行体外培养, qRT-PCR结果显示, 敲低Ell3可上调L1Md_T和Akt3的表达, 而L1Md_Gf水平保持不变(图3F和图3G)。进一步的免疫荧光实验表明,ELL3缺失的囊胚中AKT3水平增加, 而p-ERK1/2信号水平降低。使用AKT抑制剂MK2206处理囊胚后,成功抑制了AKT的表达, 并观察到ELL3缺失囊胚中的p-ERK1/2水平得到了一定程度的挽救(图3H), 说明ELL3可通过调节AKT3影响早期胚胎发育过程中ERK磷酸化水平。
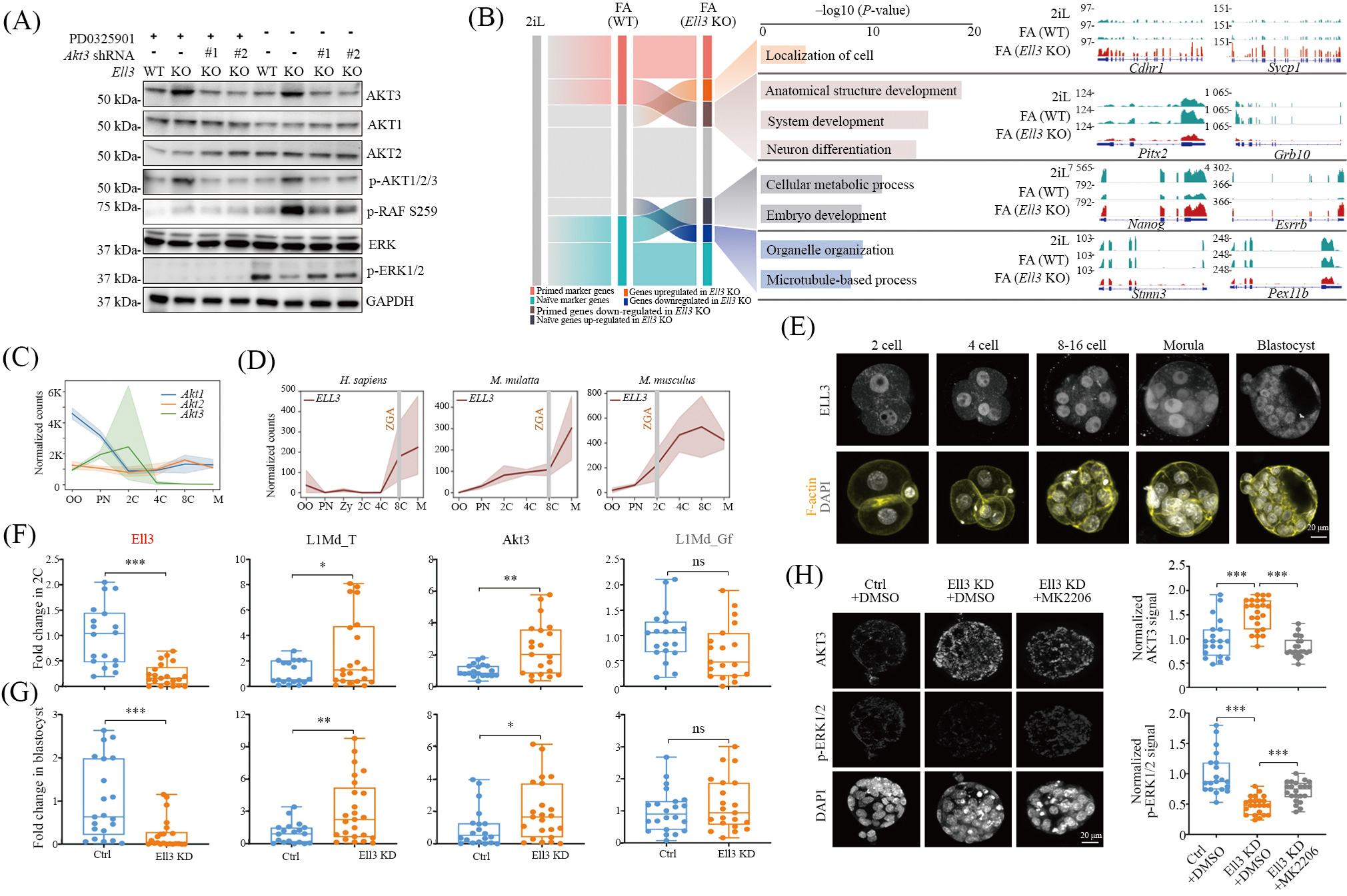 A: Western blot分析显示WT、Ell3 KO和Akt3 KD mESC中AKT1、AKT2、AKT3、p-AKT1/2/3、p-RAF S259、ERK、p-ERK1/2的蛋白水平。所示样品细胞经PD0325901处理以抑制ERK通路。使用GAPDH作为负载对照。B: Alluvial图显示Ell3 KO影响了一部分始发态标志基因的激活上调(红色), 以及FA处理后一些原始态标志基因的下调(蓝色)(左图)。中图显示了受Ell3 KO影响的不同类别基因的功能注释。RNA-seq可视化显示WT和Ell3 KO mESC在FA处理前后Cdhr1、Sycp1、Pitx2、Grb10、Nanog、Esrrb、Stmn3和Pex11b的RNA水平(右图)。分析使用的是唯一映射的reads。C: 折线图显示小鼠卵母细胞(OO)、原核(PN)、2细胞胚胎(2C)、4细胞胚胎(4C)、8细胞胚胎(8C)和卵块(M)中Akt1、Akt2和Akt3的RNA水平变化。D: 折线图显示人类(左图)、恒河猴(中图)和小鼠(右图)卵母细胞、原核、2细胞胚胎、4细胞胚胎、8细胞胚胎和卵块中ELL3的RNA水平变化。E: 免疫染色显示在小鼠着床前胚胎的不同阶段的ELL3蛋白定位。F、G: 箱线图显示对照组和Ell3 KD的2C胚胎(F)和囊胚(G)中Ell3、L1Md_T、Akt3和L1Md_Gf的RNA水平。H: 免疫染色图像显示对照组和Ell3 KD囊胚中AKT3和p-ERK1/2的水平, 以及MK2206处理可以部分恢复Ell3 KD囊胚中pERK1/2的水平。箱线图显示每组中AKT3和p-ERK1/2的荧光强度(右图)。
A: Western blot分析显示WT、Ell3 KO和Akt3 KD mESC中AKT1、AKT2、AKT3、p-AKT1/2/3、p-RAF S259、ERK、p-ERK1/2的蛋白水平。所示样品细胞经PD0325901处理以抑制ERK通路。使用GAPDH作为负载对照。B: Alluvial图显示Ell3 KO影响了一部分始发态标志基因的激活上调(红色), 以及FA处理后一些原始态标志基因的下调(蓝色)(左图)。中图显示了受Ell3 KO影响的不同类别基因的功能注释。RNA-seq可视化显示WT和Ell3 KO mESC在FA处理前后Cdhr1、Sycp1、Pitx2、Grb10、Nanog、Esrrb、Stmn3和Pex11b的RNA水平(右图)。分析使用的是唯一映射的reads。C: 折线图显示小鼠卵母细胞(OO)、原核(PN)、2细胞胚胎(2C)、4细胞胚胎(4C)、8细胞胚胎(8C)和卵块(M)中Akt1、Akt2和Akt3的RNA水平变化。D: 折线图显示人类(左图)、恒河猴(中图)和小鼠(右图)卵母细胞、原核、2细胞胚胎、4细胞胚胎、8细胞胚胎和卵块中ELL3的RNA水平变化。E: 免疫染色显示在小鼠着床前胚胎的不同阶段的ELL3蛋白定位。F、G: 箱线图显示对照组和Ell3 KD的2C胚胎(F)和囊胚(G)中Ell3、L1Md_T、Akt3和L1Md_Gf的RNA水平。H: 免疫染色图像显示对照组和Ell3 KD囊胚中AKT3和p-ERK1/2的水平, 以及MK2206处理可以部分恢复Ell3 KD囊胚中pERK1/2的水平。箱线图显示每组中AKT3和p-ERK1/2的荧光强度(右图)。
A: Western blot analysis showing protein levels of AKT1, AKT2, AKT3, p-AKT1/2/3, p-RAF S259, ERK, p-ERK1/2 in WT, Ell3 KO and Akt3KD mESC. Indicated cells were treated with PD0325901 to inhibit ERK pathway. As a loading control, GAPDH was used. B: alluvial plot showing that Ell3 KO impairs the induction of a subset of the primed signature genes (in red), and the down-regulation of some of the naïve markgenes after FA treatment (in blue) (left panel). Functional annotation of affected genes by Ell3 KO in each class are shown (middle panel). IGVbrowser tracks showing the RNA-seq signals of Cdhr1, Sycp1, Pitx2, Grb10, Nanog, Esrrb, Stmn3 and Pex11b in WT and Ell3 KO mESC beforeand after FA treatment (right panel). Uniquely mapped reads were used for the analysis. C: line graphs showing changes of Akt1, Akt2 and Akt3RNA level in mouse oocyte (OO), pronucleus (PN), 2 cell embryo (2C), 4 cell embryo (4C), 8 cell embryo (8C) and morula (M). D: line graphsshowing changes of ELL3 RNA in human (left panel), rhesus macaque (middle panel) and mouse (right panel) oocyte, pronucleus, 2 cell embryo,4 cell embryo, 8 cell embryo and morula. E: representative immunostaining showing ELL3 localization in murine pre-implantation embryos atdifferent stages. F,G: box plots showing the RNA expression levels of Ell3, L1Md_T, Akt3 and L1Md_Gf in control and Ell3 KD 2C embryos (F)and blastocysts (G). H: representative immunostaining images showing the levels of AKT3 and p-ERK1/2 in control and Ell3 KD blastocystswith or without MK2206 treatment. Box plots of the fluorescence intensity of AKT3 and p-ERK1/2 in each group (right panel).
图3 ELL3对于小鼠ESC和植入前胚胎的ERK适当激活至关重要(数据修改自参考文献[16])
Fig.3 ELL3 is essential for proper ERK activation in both mouse ESC and pre-implantation embryos(modified from reference [16])
5 总结与展望
在胚胎干细胞中, 转录延伸因子ELL3是RNAPol II延伸因子家族的成员。ELL3能够与增强子结合, 并调控小鼠胚胎干细胞中RNA Pol II在发育调节基因启动子近端的结合。这种调控作用在干细胞谱系分化中起到重要作用 [17]。在本研究中 ,我们发现ELL3在原始态胚胎干细胞中主要结合在LINE-1转座子 L1Md_T上并招募 SIN3A和 TET1,进而抑制附近基因的转录活性。我们利用三维染色质构象micro-C组学数据及4C分析发现, L1Md_T与相邻基因的启动子存在相互作用, 这提示它们可能作为增强子行使转录调控功能。进一步 , 我们发现ELL3可通过调控L1Md_T上的5hmc修饰和H3K27ac富集水平 , 进而调控其增强子活性。更重要的 , 我们发现 ELL3结合的一个 L1Md_T增强子能够调控Akt3的转录。在ESC和着床前胚胎中 ,抑制 ELL3表达会导致 Akt3的过度激活 , 进而抑制ERK的磷酸化。总之 , 我们的研究发现 , ELL3在ESC中与L1Md_T基因结合, 进而调节邻近基因的表达。特别地 , ELL3通过抑制 Akt3基因上 L1Md_T增强子活性来抑制 Akt3基因的表达 , 进而调节RAF-ERK通路的激活, 从而调控干细胞多能性(图4)。这些研究结果揭示了ELL3在ESC多能性和早期胚胎发育中的关键调节作用。
转座子是一类能够自主插入到宿主基因组中的DNA序列, 其中LINE-1(L1)转座子的丰度最高。在这项研究中, 我们发现ELL3结合的LINE-1基因具有增强子的功能, 可以调控附近基因的表达。我们还发现, ELL3结合的L1Md_T基因不仅富集有增强子标志物H3K4me1和H3K27ac, 还富集启动子标志H3K4me3。这表明这个区域不仅在转座子的调控中扮演重要角色, 还可在调控附近基因的表达中发挥作用。最近的研究也发现了一类具有增强子活性的启动子[22-24]。因此, 我们的发现为增强子和启动子的研究提供了新的视角。通过调控LINE-1基因, ELL3为宿主基因组提供了一种新的转录调控层次。这对于我们深入了解干细胞谱系分化的分子机制, 揭示基因调控网络的复杂性和多样性, 探索细胞信号转导通路的调控机制和生物学过程具有重要意义。此外, 这项研究还有助于推动干细胞研究和应用的发展, 为干细胞领域的进一步研究和临床应用提供了重要的基础和指导。
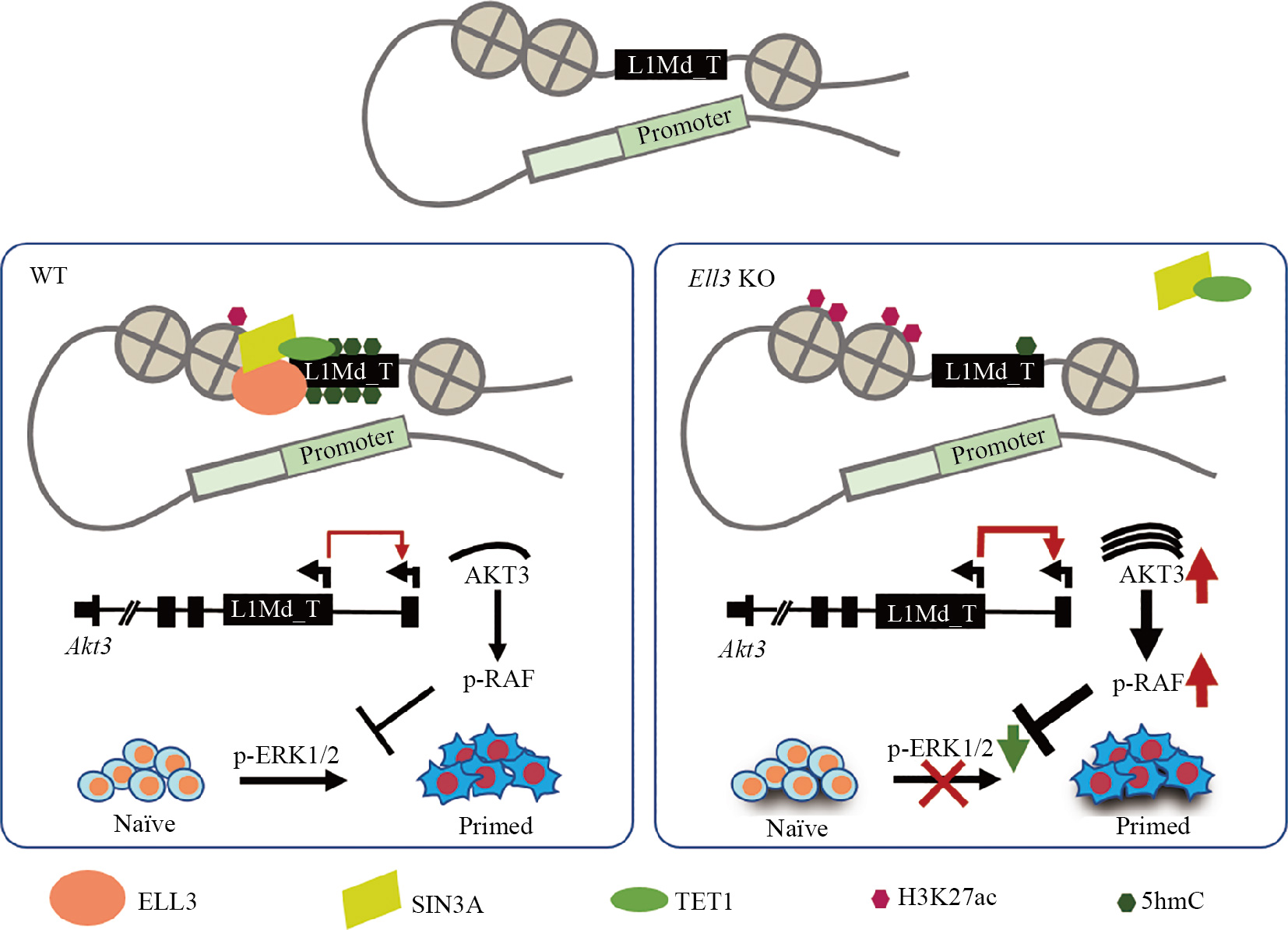
ELL3结合的L1Md_T作为增强子与附近基因如Akt3相互作用并调控其表达。ELL3缺失导致L1Md_T上5hmC修饰减少, H3K27ac富集增加, 从而导致L1Md_T附近基因, 包括Akt3的异常激活。ELL3缺失后AKT3的异常激活抑制了ERK的活性, 从而阻碍原始态–始发态多能性转化。
ELL3 bound L1Md_T serve as enhancers that facilitate physical interaction and activation of neighboring genes, such as Akt3. Depletion of ELL3 leadsto a decrease in 5hmC levels, an increase in H3K27ac levels, and up-regulation of nearby genes including Akt3. The aberrant activation of AKT3 following ELL3 depletion inhibits ERK activity and hinders the transition from naïve to primed pluripotency.
图4 ELL3通过L1Md_T-AKT3-ERK途径调节原始态–始发态转变的分子机制模型(数据修改自参考文献[16])
Fig.4 Model showing how ELL3 affects naïve-primed transition via its connection to the L1Md_T-AKT3-ERK pathway(modified from reference [16])
参考文献 (References)
[1] GOODIER J L, KAZAZIAN H H, Jr. Retrotransposons revisited:the restraint and rehabilitation of parasites [J]. Cell, 2008, 135(1):23-35.
[2] LANDER E S, LINTON L M. Initial sequencing and analysis ofthe human genome [J]. Nature, 2001, 409: 860-921.
[3] COUFAL N G, GARCIA-PEREZ J L, PENG G E, et al. L1retrotransposition in human neural progenitor cells [J]. Nature,2009, 460(7259): 1127-31.
[4] BECK C R, COLLIER P, MACFARLANE C, et al. LINE-1retrotransposition activity in human genomes [J]. Cell, 2010,141(7): 1159-70.
[5] JACHOWICZ J W, BING X, PONTABRY J, et al. LINE-1 activation after fertilization regulates global chromatin accessibility inthe early mouse embryo [J]. Nat Genet, 2017, 49(10): 1502-10.
[6] CHENAIS B. Transposable elements and human cancer: a causalrelationship [J]? Biochim Biophys Acta, 2013, 1835(1): 28-35.
[7] MORRISH T A, GARCIA-PEREZ J L, STAMATO T D, et al.Endonuclease-independent LINE-1 retrotransposition at mammalian telomeres [J]. Nature, 2007, 446(7132): 208-12.
[8] PERCHARDE M, LIN C J, YIN Y, et al. A LINE1-nucleolinpartnership regulates early development and ESC identity [J].Cell, 2018, 174(2): 391-405,e19.
[9] WEI J, YU X. FTO mediates LINE1 m6A demethylation andchromatin regulation in mESCs and mouse development [J]. Nature, 2022, 376(6596): 968-73.
[10] BULUT-KARSLIOGLU A, DE LA ROSA-VELAZQUEZ I A,RAMIREZ F, et al. Suv39h-dependent H3K9me3 marks intactretrotransposons and silences LINE elements in mouse embryonic stem cells [J]. Mol Cell, 2014, 55(2): 277-90.
[11] ROWE H M, JAKOBSSON J, MESNARD D, et al. KAP1 controls endogenous retroviruses in embryonic stem cells [J]. Nature,2010, 463(7278): 237-40.
[12] FICZ G, BRANCO M R, SEISENBERGER S, et al. Dynamicregulation of 5-hydroxymethylcytosine in mouse ES cells andduring differentiation [J]. Nature, 2011, 473(7347): 398-402.
[13] DE LA RICA L, DENIZ O, CHENG K C, et al. TET-dependentregulation of retrotransposable elements in mouse embryonicstem cells [J]. Genome Biol, 2016, 17(1): 234.
[14] DE IACO A, COUDRAY A, DUC J, et al. DPPA2 and DPPA4are necessary to establish a 2C-like state in mouse embryonicstem cells [J]. EMBO Rep, 2019, 20(5): e47382.
[15] FADLOUN A, LE GRAS S, JOST B, et al. Chromatin signaturesand retrotransposon profiling in mouse embryos reveal regulationof LINE-1 by RNA [J]. Nat Struct Mol Biol, 2013, 20(3): 332-8.
[16] MENG S, LIU X, ZHU S, et al. Young LINE-1 transposon 5′UTRs marked by elongation factor ELL3 function as enhancersto regulate naive pluripotency in embryonic stem cells [J]. NatCell Biol, 2023, 25(9): 1319-31.
[17] LIN C, GARRUSS A S, LUO Z, et al. The RNA Pol II elongationfactor Ell3 marks enhancers in ES cells and primes future geneactivation [J]. Cell, 2013, 152(1/2): 144-56.
[18] ZIMMERMANN S, MOELLING K. Phosphorylation andregulation of Raf by Akt (protein kinase B) [J]. Science, 1999,286(5445): 1741-4.
[19] HALET G, VIARD P, CARROLL J. Constitutive PtdIns (3,4,5)P3 synthesis promotes the development and survival of earlymammalian embryos [J]. Development, 2008, 135(3): 425-9.
[20] RILEY J K, CARAYANNOPOULOS M O, WYMAN A H, et al.The PI3K/Akt pathway is present and functional in the preimplantation mouse embryo [J]. Dev Biol, 2005, 284(2): 377-86.
[21] CHEN J, LIAN X, DU J, et al. Inhibition of phosphorylatedSer473-Akt from translocating into the nucleus contributes to2-cell arrest and defective zygotic genome activation in mousepreimplantation embryogenesis [J]. Dev Growth Differ, 2016,58(3): 280-92.
[22] DAO L T M, GALINDO-ALBARRAN A O, CASTRO-MONDRAGON J A, et al. Genome-wide characterization of mammalian promoters with distal enhancer functions [J]. Nat Genet,2017, 49(7): 1073-81.[23] ENGREITZ J M, HAINES J E, PEREZ E M, et al. Local regulation of gene expression by lncRNA promoters, transcription andsplicing [J]. Nature, 2016, 539(7629): 452-5.
[24] RAJAGOPAL N, SRINIVASAN S, KOOSHESH K, et al. Highthroughput mapping of regulatory DNA [J]. Nat Biotechnol,2016, 34(2): 167-74.



 中文版
中文版 英文版
英文版