领域前沿·中国
损伤应答的系统性机制: 探寻再生医学的“杠杆点”
韩宇1 张慧2*
(1干细胞转化研究中心, 香港 999077; 2深圳生育调控重点实验室, 生殖医学中心, 香港大学深圳医院, 深圳 518053)
| 张慧博士现任香港大学深圳医院研究员, 长期致力于心血管疾病创新疗法的开发。她于华东师范大学获本科及博士学位, 后赴美国密歇根大学(安娜堡)医学院病理学系完成博士后研究(2013.04至2019.03)。她曾在中国医学科学院阜外医院、心血管疾病国家重点实验室担任独立课题组PI(2019.04至2025.04)。张慧博士聚焦心血管转化医学, 致力于整合多组学技术发掘新药靶点, 并构建患者来源心脏类器官模型, 系统开展高通量定量功能学研究, 以精准解析疾病机制、加速药物临床前评价。她的长期目标是建立基于类器官的体外临床试验等效性评价体系与核心方法学, 推动类器官研究向临床实践的系统性转化。 |
损伤应答的系统性机制: 探寻再生医学的“杠杆点”
韩宇1 张慧2*
(1干细胞转化研究中心, 香港 999077; 2深圳生育调控重点实验室, 生殖医学中心, 香港大学深圳医院, 深圳 518053)
【摘要】
组织损伤响应是生物维持体内稳态的核心能力, 而再生则是这种响应能力的最优结果。传统再生研究多聚焦于局部修复事件, 忽视了机体作为复杂系统的整体性响应。该文引入系统论视角, 提出损伤响应是一个跨尺度、多层次、动态协调的系统工程, 旨在揭示器官级别损伤响应的基本原理, 并识别其中具有调控杠杆作用的关键节点, 为再生医学提供新的理论基础和干预策略。
【关键词】远程损伤响应; 再生; 杠杆点
Systemic Mechanisms of Injury Response: Toward a “Leverage Points”in Regenerative Medicine
HAN Yu1, ZHANG Hui2*
(1Centre for Translational Stem Cell Biology, Hong Kong, 999077, China; 2Shenzhen Key Laboratory of Fertility Regulation, Reproductive Medicine Center, the University of Hong Kong-Shenzhen Hospital, Shenzhen 518053, China)
【Abstract】The tissue injury response is a fundamental capacity for maintaining homeostasis, with regeneration being the optimal outcome. Traditional research has focused on localised repair, inadequately considering the dynamics of the entire organism within the complex system. This review takes a systems-level approach, proposing that the injury response is a trans-scale, multi-tiered, dynamically coordinated programme. By revealing principles at the organ level following injury and identifying key regulatory nodes—the programme's underlying leverage points—this framework establishes new theoretical foundations and intervention strategies for regenerative medicine.
【Keywords】remote injury response; regeneration; leverage points
组织损伤会触发器官整体水平的, 甚至是跨越器官边界的系统性响应, 其网络拓扑与调控逻辑至今未明。传统研究聚焦于损伤局部微环境, 将修复视为细胞自主事件; 然而, 近年对斑马鱼、蝾螈与新生小鼠等再生模型的高维解析揭示, 远端未受损组织可通过循环、神经及表观基因组轴, 主动“感知”损伤并重塑自身转录程序, 从而决定修复结局。尤其令人振奋的是, 近来远端组织再生增强子(remote tissue regeneration enhancer elements, r-TREEs)的发现, 为“同一损伤信号、不同器官响应”提供了可编程的DNA框架; 而最近哺乳动物溶菌酶2(lysozyme 2, LYZ2)介导的远程损伤反应被发现—其远程激活介导心内膜细胞外基质的病理性降解, 而靶向抑制LYZ2可在成年小鼠梗死模型中显著恢复心功能—提示损伤诱导的LYZ2可能作为一种器官损伤响应的“杠杆点”。这些分子证据提示系统性调控网络与局部细胞再生潜能共同定义了再生能力差异, 并将宏观生理现象锚定到可干预的分子节点。
1 损伤响应范畴的演进: 从局部自主到系统依赖
在再生生物学研究的早期阶段, 科学家们主要关注的是损伤部位的局部微环境, 并认为组织的修复与再生在很大程度上是一个“自主”的过程。这一范式强调, 损伤局部释放的信号分子、细胞间的直接接触以及细胞外基质的重塑是决定修复结果的核心因素。这种以局部为中心的观点, 在许多经典的再生模型中得到了印证, 并为理解细胞和组织的基本修复机制奠定了基础。
1.1 涡虫再生中的局部成形素梯度理论
涡虫(Planarian)作为一种拥有强大再生能力的模式生物, 其研究为局部自主修复理论提供了经典的范例。当涡虫的身体被切割成碎片时, 每一个碎片都有能力再生出一个完整的个体。早期的研究,特别是基于新芽殖(blastema-based)的再生模型, 提出了“成形素梯度”(morphogen gradient)理论来解释这一现象[1]。该理论认为, 在涡虫体内存在着一种或多种被称为“成形素”的信号分子, 它们在体内形成稳定的浓度梯度, 为不同部位的细胞提供了“位置信息”。当身体被切断后, 这种梯度被打破, 伤口边缘的细胞会感知到这种变化, 并根据其所在位置相对于新形成的组织边界(如头部或尾部)的距离, 启动相应的再生程序, 最终形成正确的身体结构[2]。
以上模型将再生的指令来源完全定位于损伤局部, 强调了细胞自主解读位置信息并执行再生程序的能力, 是局部决定论的典型代表[3]。
1.2 心脏再生中局部细胞类型的内在重塑能力
在心脏再生领域, 早期的研究同样聚焦于损伤局部心肌细胞(cardiomyocytes, CMs)的内在潜能。研究人员致力于探索心肌细胞在损伤后是否能够重新进入细胞周期并进行增殖, 以实现心肌的再生。例如, 在斑马鱼这一拥有强大心脏再生能力的模型中, 研究发现, 心脏被切除高达20%的心室尖端后,伤口处会迅速形成血凝块, 随后被新生的心肌组织所取代, 在30至60天内实现近乎完美的心脏结构和功能恢复[4]。这一过程的核心被认为是伤口边缘的心肌细胞发生了去分化, 重新获得了增殖能力, 形成了所谓的“再生芽基”(regeneration blastema), 并最终分化成了新的心肌细胞[5]。这种观点认为, 心肌细胞本身就蕴含着再生的“蓝图”, 损伤只是激活了其内在的、沉睡的重塑程序。同样, 在哺乳动物新生小鼠的心脏再生研究中, 也发现出生一周内的心肌细胞具有较强的增殖能力, 能够在损伤后实现一定程度的再生[6]。这些前期发现都强化了这样一种观念: 再生能力主要取决于损伤局部关键细胞类型(如心肌细胞)的内在可塑性(如损伤激活的心肌细胞重新进入细胞周期和增殖)。
2 系统性协调的损伤应答模式
随着研究技术的进步, 特别是单细胞测序、谱系追踪和系统生物学方法的应用, 科学家们逐渐认识到, 将组织修复视为一个纯粹的局部自主过程是过于简化的。越来越多的证据表明, 成功的再生是一个高度协同的、系统性的工程, 它不仅依赖于损伤局部的细胞, 更需要多种非局部细胞类型, 甚至远端组织/器官的精密协作—这要求我们深入揭示重要器官损伤后功能修复的系统性内在规律。
2.1 系统论视角下的损伤后心脏功能恢复
重要器官心脏的再生是一个复杂的过程, 最显著的标志是损伤区域心肌组织的再生(再肌肉化)和血管网络的重建(再血管化)。值得注意的是, 在哺乳动物大动物模型中, 即便心肌组织再肌肉化成功达成, 伴随的恶性心律失常现象仍是一个明显的“整体大于局部”的例子。损伤后响应过程在种种限制下功能修复不成功, 表现为纤维化、免疫过度激活和长期功能代偿引发的器官功能衰竭[7]。
从系统论角度看, 这些局部过程并非自主进行的, 而是依赖于整个生物体提供的信息、能量和物质的支持。系统论强调整体大于部分之和, 这一原理在再生过程中体现为: 局部再生效率高度依赖于系统性的协调与支持。
2.2 器官损伤系统应答模式: 以非损伤局部的心内膜应答为例
心内膜(endocardium)作为心脏内壁的单层特化的内皮细胞, 长期以来被认为主要起血液与心肌组织间的屏障作用。然而, 近年的研究揭示了心内膜细胞在心脏发育和再生中的积极信号调控功能。在终身具有再生能力的斑马鱼模型中, 研究人员发现,心脏损伤后心内膜细胞会发生显著的基因表达变化, 并主动分泌多种信号分子来调控心肌细胞的增殖。例如, 损伤后心内膜细胞会激活视黄酸(retinoic acid, RA)合成酶编码基因raldh2的表达。值得注意的是, 这种表达呈现出明显的时空动态变化: 损伤后3 h, raldh2在全部心内膜中被广泛激活; 而至损伤后1天, 其表达则局限于损伤区的心内膜细胞, 并伴随该区域的心肌增殖[8]。这一发现表明, 心脏再生的调控不仅限于损伤区细胞, 还涉及由特定基因标记的心内膜发生的远程激活, 从而提示存在一种跨区域协调的器官水平应答模式。
2.3 再生能力差异的系统性因素
为什么斑马鱼和蝾螈能够完美再生心脏和肢体, 而成年哺乳动物却几乎完全丧失了这种能力?传统的观点多从细胞自主性角度解释, 认为哺乳动物的心肌细胞已经永久退出了细胞周期, 或者其干细胞/祖细胞的数量和潜能有限[9-10]。然而, 系统性因素的重要性日益凸显。一个有力的证据来自于“异时共生”(heterochronic parabiosis)实验。在该实验中, 将年轻小鼠和老年小鼠的循环系统通过手术连接起来, 共享血液。结果发现, 年轻小鼠的血液能够显著增强年老小鼠体内多种组织(如骨骼肌和肝脏)的再生能力。这一里程碑式的发现表明, 老年动物的干细胞和微环境(niche)本身并未完全丧失再生能力, 而是被循环系统中的某些“抑制性”因子所压制。反之, 老年小鼠的血液则会抑制年轻小鼠的再生潜能[11]。这有力地证明了系统环境, 特别是循环系统中的体液因子, 是决定再生能力的关键。
近期研究揭示RA信号不仅是斑马鱼心肌再生的关键因素[8], 且RA信号的强弱同样决定了哺乳动物耳廓再生与否[12]。损伤后, 耳廓可再生物种(如兔)高表达Aldh1a2(合成RA的限速酶); 而在小鼠和大鼠(丧失耳廓再生能力的物种)中, Aldh1a2基因关联的增强子元件失活, 导致该基因损伤后表达水平不足; 其后果是RA合成受阻, 无法提供必要的RA信号以驱动“损伤诱导成纤维细胞”(wound-induced fibroblasts, WIF)进行形态发生, 最终造成再生失败[12]。通过注射RA或插入兔AE1增强子驱动Aldh1a2基因表达, 可恢复小鼠耳廓再生, 包括软骨和神经组织的重建。新证据的积累正重塑我们对再生能力的认知: 哺乳动物的再生能力受限, 不仅源于细胞自身的缺陷, 更与整个系统性抑制环境(如机体衰老或进化机制)密切相关。
3 器官损伤系统应答的远端机制解析: 从现象描述到分子界定
生物体对损伤的系统性响应, 长期以来被认为主要由两大经典通路介导: 神经调控和体液因子调控。早期的研究多停留在现象描述层面, 例如观察到去神经支配会抑制再生, 或者发现损伤后血液中炎症因子水平升高。这些证据表明, 损伤修复或再生过程中器官间的通讯是双向且特异的, 每个器官都可能既是信号的发送者, 也是信号的接收者和响应者, 共同构成了一个复杂的、动态的全身性调控网络[13]。
然而, 近十年的研究借助先进的分子生物学技术, 对这些经典通路进行了全新的诠释, 深入揭示了其精确的分子机制和细胞靶点。另外, 各种损伤模型和远程损伤信号最终需要通过细胞内(innate)信号转导通路来执行其功能。近年来, 研究发现在多种不同物种中均被激活的关键因子(如RA信号)[8,12]和调控元件, 揭示了器官损伤应答模式的保守性和普遍性。
3.1 关键因子(如CEBPD)在远端器官中的特异性表达
CCAAT/增强子结合蛋白δ(CCAAT enhancer binding protein delta, CEBPD)是一个转录因子, 在多种应激条件下被激活。有趣的是, 研究发现CEBPD在远程损伤响应中也扮演着重要角色。在斑马鱼心脏再生模型中, CEBPD不仅在损伤局部的心脏中被激活, 还在远端器官(如大脑和肾脏)中特异性表达。同样, 在小鼠指尖再生模型中, CEBPD也被发现是关键的调控因子[14]。
这种在不同物种、不同损伤模型中的保守性激活模式, 提示CEBPD可能是一个核心的远程损伤响应因子。它可能作为损伤信号的“传感器”或“执行者”, 在远端器官中启动特定的基因表达程序, 从而协调全身的修复反应。对CEBPD及其下游靶基因的深入研究, 将有助于我们理解远程响应的普适性机制。
3.2 增强子在决定基因局部与远程表达反应中的关键作用
基因的表达调控不仅依赖于转录因子, 还受到DNA上非编码区—增强子的精密控制。增强子能够像“开关”一样, 决定一个基因在何时、何地, 以何种水平表达。在远程损伤响应中, 增强子的作用尤为关键。与仅在损伤局部激活的TREEs(tissue regeneration enhancer elements)不同[15-16], 远端组织再生增强子(r-TREEs)概念源于对斑马鱼心脏再生过程中远端器官反应的研究, 被定义为“在远端器官中检测损伤信号并启动再生响应程序的结构”, 是一类能够响应远程信号的增强子[14]。
为了验证r-TREEs的功能, 研究人员以斑马鱼心脏再生为模型, 进行了一系列精密的实验。他们发现, 在心脏损伤后, 斑马鱼大脑中的一个名为CEN的增强子被激活, 该增强子能够检测到由肾上腺皮质释放的糖皮质激素信号, 进而指导其靶基因cebpd在未受伤的大脑组织中表达。这一发现清晰地描绘了一条从损伤器官(心脏)到内分泌器官(肾上腺), 再到远端器官(大脑)的信号转导通路, 而r-TREEs(CEN)正是这条通路的终点执行者。更有趣的是, 当研究人员对另一个远端器官—肾脏进行分析时, 发现了另一组截然不同的候选r-TREEs, 它们调控着与骨髓功能相关的基因程序[14]。这表明,不同的远端组织可能利用各自特异的r-TREEs来“过滤”和“解读”相同的系统性损伤信号[17], 从而启动最适合自身生理功能的适应性反应。
r-TREEs的功能跨越了器官边界, 使得未直接受损的组织也能参与到整体的修复过程中。这一发现突破了传统上对增强子功能的认知, 将其从靶器官基因调控元件提升到了系统性生理响应协调者的地位。
3.3 损伤诱导的LYZ2: 一个跨器官损伤响应的系统性“杠杆点”
系统生物学将能对复杂系统产生巨大影响的关键节点定义为“杠杆点”。揭示器官损伤响应原理的核心在于识别此类节点, 这将为器官损伤后的功能修复建立新的理论体系并开发相应的干预策略。
我们近期的研究在哺乳动物心脏损伤模型中揭示溶菌酶(LYZ2, 传统髓系细胞标志物)在非免疫细胞中介导的“远程损伤响应”(remote injury response)[18]。上述研究利用出生后1天的小鼠(P1, 具有再生能力)和出生后7天的小鼠(P7, 再生能力丧失)构建心尖切除(apical resection, AR)模型, 巧妙地将损伤区域[梗死区(infarcted zones, IZ)]与未直接受损的远端区域(左心室心内膜区)进行空间区分。研究以心内膜细胞为“远程响应”的代表—因其解剖位置明确远离手术造成的局IZ区—通过整合空间转录组学和单细胞RNA测序技术, 发现损伤可诱导Lyz2基因在P1与P7心脏的多种细胞类型中显著上调(图1)。该基因表达上调不仅出现在IZ区, 也存在于远离IZ区的左心室心内膜区。尤为关键的是, 该研究揭示了局部损伤可远程诱导Lyz2在心内膜激活,且其表达在再生性P1心脏中短暂上调, 在非再生性P7心脏中则持续高表达, 即该基因在再生与非再生模型中表现出截然不同的表达动态。以上结果提示Lyz2基因的持续性激活可能是再生能力丧失的一个关键特征。上述核心发现为理解器官水平的远程损伤应答机制提供了一个直接的分子证据。
尽管LYZ2传统上被认为是髓系细胞的标志物,并与抗菌功能相关, 但此项研究表明, 至少在心内膜细胞中, LYZ2是一种损伤特异性触发的溶酶体活性增强因子。这一发现将LYZ2的功能从免疫防御扩展到了细胞内的物质代谢与质量控制层面。在损伤应激条件下, 细胞需要通过溶酶体途径清除受损的细胞器和蛋白质, 以维持稳态。然而, 过度的溶酶体降解活动则可能导致细胞外基质(extracellular matrix, ECM)的病理性降解, 从而加剧组织损伤。LYZ2正是在这一关键节点上发挥作用, 其表达水平直接影响了溶酶体降解的“油门”大小, 从而决定了损伤响应的走向是修复还是恶化。基于上述发现,我们进一步探索了干预LYZ2功能的治疗潜力。在小鼠心肌梗死(myocardial infarction, MI)模型中, 无论是通过基因手段敲除Lyz2(KO), 还是使用溶酶体降解抑制剂(如CA-074Me、Apilimod)进行药理学干预, 都能够显著促进非再生性心脏在损伤后的功能恢复。具体而言, 干预LYZ2功能能够有效减少左心室心内膜附近的心肌细胞凋亡, 从而起到心肌保护作用, 并最终促进心脏结构和功能的快速修复。这一结果强有力地证明了靶向发生在非心肌细胞(如心内膜细胞)中的远程损伤反应, 是一种可行且高效的治疗策略。特别是考虑到Apilimod等溶酶体抑制剂已是临床阶段的药物, 这项研究的发现具有极高的临床转化潜力, 为心肌梗死等缺血性心脏病的治疗开辟了新途径。
有趣的是, 这种损伤激活Lyz2表达模式在多种非心肌细胞类型中均有体现, 包括心内膜细胞、成纤维细胞和平滑肌细胞等(图1), 已有研究报道过其在损伤的皮肤再生和脑损伤中上调。这种损伤诱导的广泛的上调很难被部分免疫细胞的转分化所解释。这些证据提示Lyz2符合一个理想系统杠杆点的核心特征: 跨器官多细胞类型激活、具有调控功能、进化保守性(如心梗患者心内膜细胞中LYZ表达水平相较正常人升高), 提示该基因作为系统性“杠杆点”的可能。
值得注意的是, 在这个例子中, 损伤激活关键因子LYZ2所介导的损伤反应需要被限制以实现功能修复, 提示完整地理解该动态网络调控可能需要更为复杂的解析模型(如拓扑结构)。
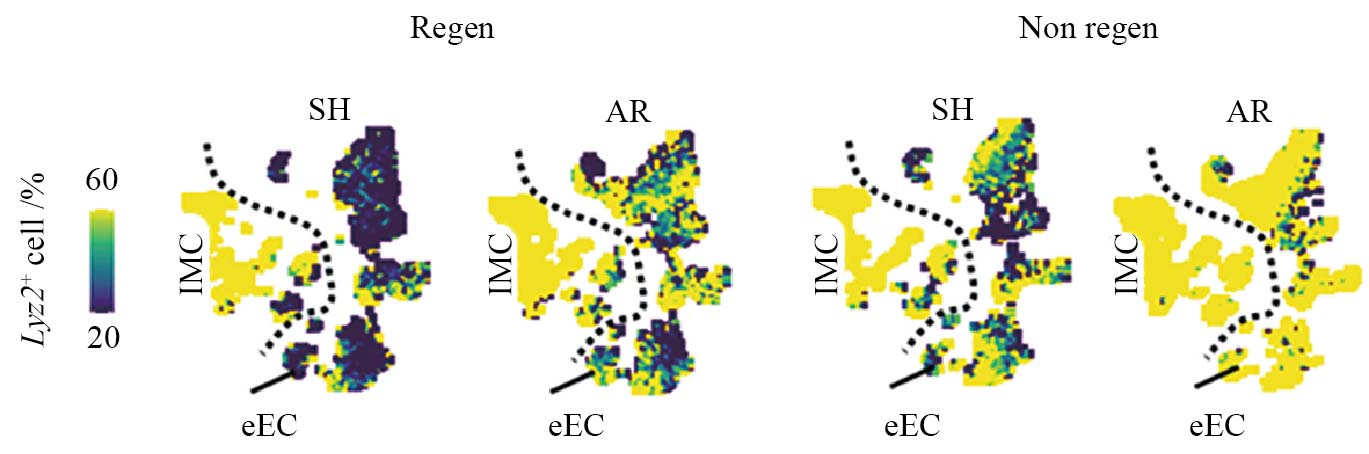
单细胞RNA测序数据的UMAP嵌入图, 显示各实验条件和细胞谱系中Lyz2+细胞的百分比(%)。Regen: 可再生心脏; non regen: 非再生心脏; AR:心尖切除术组; SH: 假手术组; eEC: 心内膜细胞; IMC: 免疫细胞。
UMAP embedding of single-cell RNA-seq data, showing percentages (%) of Lyz2+ cells across experimental conditions and lineages. Regen: regenerative hearts; non regen: non-regenerative hearts; AR: apical resection; SH: sham; eEC: endocardial cell; IMC: immune cells.
图1 与非再生心脏相比, 损伤在再生心脏的局部梗死区及远端区域中, 诱导多种细胞类型呈现差异性的Lyz2表达模式(根据参考文献[18]改编)
Fig.1 Injury induces distinct patterns of Lyz2 expression in multiple cell types in local infarcted zones and remote zones of regenerative vs. non-regenerative hearts (adapted from reference [18])
4 未来研究方向: 基于证据的技术路径
随着生物学研究进入大数据时代, 单纯依靠实验观察已难以完全解析复杂的生物系统。数学建模(AI辅助技术)作为一种强大的定量分析工具, 正越来越多地被应用于生物学研究中, 为理解损伤响应这一复杂网络提供了新的视角和方法。通过AI辅助的数学建模定量分析多器官损伤后的转录组数据,可以构建一个跨器官的基因共表达网络[19], 从中识别出像LYZ2这样的网络枢纽。这些枢纽节点不仅是理解损伤响应机制的关键, 也是潜在的药物靶点。此外, 网络理论还可以用来分析网络的拓扑结构, 如模块化、鲁棒性等, 从而揭示损伤响应系统的组织原则。
除了活细胞成像外, 其他先进的可视化技术也为理解损伤响应的复杂性提供了新的视角。例如,光片荧光显微镜(light-sheet fluorescence microscopy,LSFM)能够对大型、完整的组织样本(如整个器官或胚胎)进行快速、高分辨率的三维成像, 从而揭示细胞在组织内的空间分布和动态行为。将LSFM与组织透明化技术相结合, 可以实现对整个损伤器官的“透明化”成像, 从而全面地观察免疫细胞浸润、血管再生和细胞凋亡等过程。此外, 质谱成像技术(mass spectrometry imaging, MSI)可以在组织切片上同时检测和定位数百种代谢物和蛋白质, 从而揭示损伤后组织内代谢和信号通路的时空变化。这些先进的可视化技术, 将帮助我们从系统层面、在更高的维度上理解损伤响应的动态变化和组织原则。
为了在可控的实验条件下研究复杂的生物学过程, 建立能够模拟体内微环境的复杂体外系统至关重要。诱导多能干细胞(induced pluripotent stem cells, iPSCs)技术的发展为建立复杂体外系统提供了前所未有的机遇。通过将患者的体细胞重编程为iPSCs, 再分化为多种特定的细胞类型(如心肌细胞、内皮细胞、神经元等), 研究人员可以构建出具有特定遗传背景的、高度生理相关的体外模型。例如,为了验证损伤诱导的人心内膜LYZ(小鼠LYZ2蛋白的人源同源蛋白)在更复杂的生理环境中的效应, 我们构建了一个具有空间信息的人源心内膜–心肌共培养模型。这一体外实验不仅排除了体内复杂因素(如免疫细胞浸润)的干扰, 也清晰地展示了心内膜细胞通过LYZ2-HSPG轴对心肌细胞活性的直接影响, 为理解远程损伤响应如何导致心功能恶化提供了清晰的分子证据[18]。后续研究中, 研究人员可进一步构建具有更复杂心脏细胞谱系、结构及功能的患者特异性心脏类器官, 以期在更接近生理条件的背景下实现活细胞成像—通过荧光标记技术实时追踪损伤后信号分子的动态传导过程, 从而为心脏损伤响应机制研究提供具备高时空分辨率的动态观测方法。
5 总结与展望
5.1 损伤系统性响应研究的现状与未来
当前, 对损伤系统性响应的研究正处于一个从描述性科学向机制性科学深刻转变的关键时期。以LYZ2和r-TREEs的发现为代表, 研究者们已经开始能够精确地界定损伤响应网络中的关键节点和调控框架, 将宏观的生理现象与微观的分子机制联系起来。未来的研究将更加注重系统性和整合性, 需要综合利用单细胞多组学、空间转录组学、蛋白质组学和代谢组学等技术, 在不同的时间点和空间尺度上, 全面、动态地描绘损伤响应的全景图。此外, 跨物种的比较研究将变得尤为重要, 通过比较再生能力强和弱的物种, 可以揭示决定再生成败的进化保守性机制和物种特异性差异, 为“唤醒”哺乳动物的再生潜能提供关键线索。
5.2 基础研究向治疗策略转化的潜力
这些基础研究的突破为开发全新的治疗策略提供了巨大的潜力。传统的再生医学疗法多聚焦于直接补充细胞或生长因子, 而系统性响应的研究则开辟了新的治疗思路: 靶向调控网络中的关键杠杆点。例如, 通过抑制LYZ2的功能来阻断病理性远程损伤反应, 或通过激活特定的r-TREEs来启动促再生的基因程序, 这些策略都具有“四两拨千斤”的潜力。特别是考虑到一些关键的调控通路(如溶酶体功能、神经免疫连接)已经存在临床可用的药物, 将这些药物重新定位(repurposing)用于损伤修复, 将大大缩短从基础研究到临床应用的周期。未来的治疗将不再是局限于局部干预, 而是基于对患者系统性状态的全面评估, 进行个性化的、系统性的精准调控。
5.3 定量建模与空间可视化技术在未来研究中的重要性
面对损伤响应这一高度复杂的系统, 未来的研究将越来越依赖于定量建模和空间可视化等先进技术。AI辅助的数学模型能够帮助我们从海量数据中提取规律, 预测系统行为, 并为实验设计提供理论指导。而空间可视化技术则能将抽象的分子数据转化为直观的、具有空间信息的图像, 帮助我们理解细胞和组织在三维空间中的动态变化。这两种技术的结合, 将使我们能够在保持生物学复杂性的同时, 极大地提高研究的解析度和深度。最终, 通过构建一个“数字孪生”的损伤响应模型, 我们或许能够在计算机上模拟不同治疗方案的效果, 为每一位患者量身定制最优的治疗策略, 真正实现精准再生医学的宏伟目标。
致谢
限于篇幅, 本文未能涵盖领域内诸多杰出工作,谨向所有相关研究团队致以诚挚歉意。
参考文献 (References)
[1] ZENG A, LI H, GUO L, et al. Prospectively isolated tetraspanin+neoblasts are adult pluripotent stem cells underlying planaria regeneration [J]. Cell, 2018, 173(7): 1593-608,e20.
[2] WAGNER D E, WANG I E, REDDIEN P W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration [J]. Science, 2011, 332(6031): 811-6.
[3] REDDIEN P W. Positional information and stem cells combine to result in planarian regeneration [J]. Cold Spring Harb Perspect Biol, 2022, 14(4): a040717.
[4] POSS K D, WILSON L G, KEATING M T. Heart regeneration in zebrafish [J]. Science, 2002, 298(5601): 2188-90.
[5] KIKUCHI K, HOLDWAY J E, WERDICH A A, et al. Primary contribution to zebrafish heart regeneration by gata4+ cardiomyocytes [J]. Nature, 2010, 464(7288): 601-5.
[6] PORRELLO E R, MAHMOUD A I, SIMPSON E, et al. Transient regenerative potential of the neonatal mouse heart [J]. Science, 2011, 331(6020): 1078-80.
[7] BERTERO A, MURRY C E. Hallmarks of cardiac regeneration [J]. Nat Rev Cardiol, 2018, 15(10): 579-80.
[8] KIKUCHI K, HOLDWAY J E, MAJOR R J, et al. Retinoic acid production by endocardium and epicardium is an injury response essential for zebrafish heart regeneration [J]. Dev Cell, 2011, 20(3): 397-404.
[9] PUENTE B N, KIMURA W, MURALIDHAR S A, et al. The oxygen-rich postnatal environment induces cardiomyocyte cellcycle arrest through DNA damage response [J]. Cell, 2014, 157(3): 565-79.
[10] HIROSE K, PAYUMO A Y, CUTIE S, et al. Evidence for hormonal control of heart regenerative capacity during endothermy acquisition [J]. Science, 2019, 364(6436): 184-8.
[11] CONBOY I M, CONBOY M J, WAGERS A J, et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment [J]. Nature, 2005, 433(7027): 760-4.
[12] LIN W, JIA X, SHI X, et al. Reactivation of mammalian regeneration by turning on an evolutionarily disabled genetic switch [J]. Science, 2025, 388(6754): eadp0176.
[13] SUN F, POSS K D. Inter-organ communication during tissue regeneration [J]. Development, 2023, 150(23): dev202166.
[14] SUN F, OU J, SHOFFNER A R, et al. Enhancer selection dictates gene expression responses in remote organs during tissue regeneration [J]. Nat Cell Biol, 2022, 24(5): 685-96.
[15] KANG J, HU J, KARRA R, et al. Modulation of tissue repair by regeneration enhancer elements [J]. Nature, 2016, 532(7598): 201-6.
[16] BEGEMAN I J, SHIN K, OSORIO-MÉNDEZ D, et al. Decoding an organ regeneration switch by dissecting cardiac regeneration enhancers [J]. Development, 2020, 147(24): dev194019.
[17] ZLATANOVA I, SUN F, WU R S, et al. An injury-responsive mmp14b enhancer is required for heart regeneration [J]. Sci Adv, 2023, 9(48): eadh5313.
[18] FAN C, SONG S, HAN Y, et al. Targeting lysozyme 2 in endocardium promotes rapid recovery by modulating remote injury signals [J]. Cell Stem Cell, 2025, 32(10): 1563-76,e11.
[19] YAO Z, LI B, LU Y, et al. Single-cell analysis via manifold fitting: a framework for RNA clustering and beyond [J]. Proc Natl Acad Sci USA, 2024, 121(37): e2400002121.




 中文版
中文版 英文版
英文版