领域前沿·中国
载脂蛋白APOL特异性结合拟杆菌目细菌并调控黏膜稳态
杨涛* 胡孝虎 钱友存*
(免疫与疾病研究组, 中国科学院上海营养与健康研究所, 中国科学院大学, 上海 200031)
 | 钱友存研究员, 中国科学院上海营养与健康研究所国家重点研发计划首席。南京师范大学本科、硕士, 中国科学院上海药物研究所博士, 曾在美国克里夫兰临床基金会做博士后、研究助理、研究助理教授。主要从事IL-17家族细胞因子和黏膜免疫方面的研究工作, 以通信作者在Nature、Nat Med、Nat Immunol、Immunity等期刊上发表一系列研究成果, 先后发表SCI论文50余篇。研究成果得到国际同行专家的高度关注和认可, 并应邀在Nat Med上发表同行专家评论。获中国科学院特聘核心研究员、中国科学院优秀研究生导师奖等多项荣誉。担任J Biol Chem、Cell Immunol、Front Immunol等期刊编委。 |
 | 杨涛, 中国科学院上海营养与健康研究所副研究员。2013年本科毕业于中国农业大学; 2019年获得中国科学院大学免疫学博士学位; 2019至2024年在中国科学院上海营养与健康研究所从事博士后工作, 从事核酸受体与肠道黏膜免疫的细胞和分子机制研究, 涵盖免疫稳态、细胞死亡及核酸代谢等多个方面。研究方向聚焦于肠道菌群与黏膜互作以及Z型核酸(Z-RNA)的产生机制、生物学功能及其在免疫系统中的多层次作用。相关研究成果发表在Nature、Nat Commun、Cell Rep等期刊上。主持上海市科委基础研究计划“自然科学基金”青年项目一项。参与国家自然科学基金重点项目、科技部蛋白质专项等多个科研项目。 |
载脂蛋白APOL特异性结合拟杆菌目细菌并调控黏膜稳态
杨涛* 胡孝虎 钱友存*
(免疫与疾病研究组, 中国科学院上海营养与健康研究所, 中国科学院大学, 上海 200031)
【摘要】肠道微生物群与宿主的共生关系是维持机体健康的核心。作为共栖者, 这些微生物除了辅助吸收营养物质外, 也能积极通过分泌代谢产物(如短链脂肪酸、胆汁酸)和结构分子(如多糖A、α-半乳糖神经酰胺)调控宿主免疫, 例如诱导调节性T细胞(Treg)分化或调节自然杀伤T细胞活性。然而, 宿主如何精准识别特定共生菌并建立互惠机制仍不明确。已知的肠道防御因子(如抗菌肽、分泌型IgA、补体C3)虽能清除病原体, 但其作用缺乏菌群特异性。针对肠道中数量众多的共生菌, 在期共进化过程中宿主是否发展出精准识别和调控这些微生物的能力, 仍待深入探索。针对该问题, 该团队通过多重蛋白组学技术鉴定发现小鼠肠上皮细胞可分泌产生一类新型载脂蛋白APOL9a/b(APOL9), 其具有共生细菌结合能力。结合流式细胞术与微生物组测序技术, 团队意外发现APOL9及其人类同源蛋白APOL2能特异性结合一类常见的拟杆菌目(Bacteroidales)肠道细菌。进一步研究表明APOL9可以特异性结合细菌表面特殊的脂质分子—神经酰胺-1-磷酸(Cer1P), 结合目标细菌后, 可以诱导其释放外膜囊泡(OMVs), 外膜囊泡可以激活树突状细胞, 促进T细胞分泌干扰素γ, 进而诱导上皮细胞MHC-II表达, 最终推动一类CD4+CD8αα+肠上皮内淋巴细胞(IELs)的发育, 从而提升肠道对外来病原微生物(如沙门氏菌)的抗感染能力。
【关键词】肠道微生物群; 拟杆菌; APOL9; 外膜囊泡; MHC-II; 上皮内淋巴细胞
Apolipoprotein APOL Specifically Binds Bacteroidales and Regulates Mucosal Homeostasis
YANG Tao*, HU Xiaohu, QIAN Youcun*
(Laboratory of Immunology and Disease, Shanghai Institute of Nutrition and Health, University of Chinese Academy of Sciences, Shanghai 200031, China)
【Abstract】The gut microbiota plays a pivotal role in maintaining host health through its complex and dynamic symbiotic relationship with the intestinal epithelium. Beyond aiding in nutrient absorption, commensal microbes modulate host immunity via metabolic products such as short-chain fatty acids and bile acids, as well as structural components including polysaccharide A and α-galactosylceramide. These microbial signals can induce Treg (regulatory T) cell differentiation and modulate NKT (natural killer T) cell activity. Despite these insights, how the host discriminates specific symbionts and establishes mutually beneficial interactions remains poorly understood. Classical intestinal defense mechanisms—including antimicrobial peptides, secretory IgA, and complement C3—lack the specificity required to target individual commensal species. Whether the host has evolved mechanisms to selectively recognize and regulate particular symbionts during coevolution remains an open and important question. Here, using integrative proteomics, the research team identify a novel class of host-derived apolipoproteins, APOL9a and APOL9b (collectively APOL9), that are secreted by murine intestinal epithelial cells and exhibit selective binding to Bacteroidales species—a dominant order of gut commensals. Functional assays demonstrate that both murine APOL9 and its human ortholog APOL2 recognize a unique lipid molecule on the bacterial surface, Cer1P (dihydroceramide-1-phosphate). Binding of APOL9 to target bacteria does not disrupt microbial viability but instead induces the release of OMVs (outer membrane vesicles). These OMVs stimulate dendritic cells and enhance IFN-γ (interferon-γ) production by T cells, leading to upregulation of MHC class II expression in intestinal epithelial cells. Consequently, this promotes the development of CD4⁺CD8αα⁺ IELs (intraepithelial lymphocytes), a specialized immune subset associated with mucosal immune defense. Functionally, this host-symbiont axis enhances resistance against enteric pathogens, including Salmonella enterica.
【Keywords】gut microbiota; Bacteroidales; apolipoprotein L9; outer membrane vesicles; MHC class II; intraepithelial lymphocytes
1 宿主和肠道微生物的广泛对话
肠道微生物群是宿主生态系统不可分割的一部分, 其种类和数量极其丰富, 与宿主共同构成了一个复杂的“超级有机体”。这些微生物不仅在能量获取、代谢调节和维生素合成等方面提供重要帮助, 还通过其代谢产物和表面分子调节宿主的免疫系统[1]。过去的研究已经表明, 诸如短链脂肪酸、次级胆汁酸、色氨酸代谢物等微生物产物能诱导宿主调节性T细胞(Tregs)或CD4+CD8αα+肠上皮内淋巴细胞(intraepithelial lymphocytes, IELs)的发育[2-6], 从而维持免疫耐受和平衡。此外, 某些共生菌, 如Bacteroides fragilis分泌的多糖A, 也被证明可通过直接作用于免疫细胞调节炎症反应[7]。
然而, 在如此多样的微生物组成中, 宿主如何实现对“有益”与“有害”菌的区分, 并选择性地加强与有益共生菌的互作以获取免疫收益, 是一个至今未解的关键科学问题。传统研究表明宿主可以依赖广谱抗菌蛋白(如抗菌肽、IgA等)进行整体调控[8-10],但这些机制大多缺乏对特定菌群的识别特异性。因此, 探索宿主是否存在一种能够特异性识别并调节某一类共生菌的策略, 以及这种机制如何影响免疫系统功能, 对于理解微生物–宿主共生关系、开发新型免疫干预策略具有重要科学与临床价值。
我们研究团队长期深耕于肠道黏膜免疫方向。我们利用蛋白质组学, 结合流式细胞术和微生物组测序技术发现宿主可以分泌APOL9分子, 特异性结合拟杆菌目细菌。该发现填补了宿主能否精准识别并调控专一类群微生物这一领域的空白, 拓宽了我们对宿主–微生物互作的理解。接下来我们将以揭示宿主如何通过分泌APOL9分子作用于特定细菌从而调控肠道免疫稳态研究为例[11], 介绍宿主–微生物作用新范式。
2 筛选并鉴定可与拟杆菌目细菌发生特异性结合的APOL9蛋白
宿主肠道黏膜层是宿主与肠道微生物互作的关键界面, 同时也是机体抵御微生物入侵的重要防线。该黏膜屏障系统由以下几部分共同构成: 以单层柱状上皮细胞及其紧密连接为核心的物理屏障;由潘氏细胞或上皮细胞分泌的防御素、溶菌酶等抗菌肽构成的化学屏障; 由共生菌群形成的生物屏障; 以及固有层中免疫细胞构成的免疫屏障[12-13]。微生物的定植或入侵可诱导上皮细胞发生转录水平的变化[14-15], 进而改变黏膜层中蛋白质的组成和比例。
为探索潜在的共生细菌结合调控因子, 我们比较了常规饲养小鼠与无菌小鼠肠道黏膜层中的差异蛋白, 以及可与肠道共生菌结合的蛋白, 最终鉴定出了一类此前尚未被功能注释的新型载脂蛋白—APOL9分子(图1A~图1C)。结合流式细胞术与微生物组测序分析(图1D), 我们发现APOL9a对拟杆菌目细菌表现出显著的结合偏好性(图1E), 这提示其与以往报道的广谱结合型宿主因子不同, 可能具有较强的特异性。进一步地, 我们探究了人类在进化过程中是否也产生了类似功能的蛋白。通过序列比对, 我们识别出与小鼠APOL9结构同源的人源蛋白APOL1~4[16]。功能验证显示, 其中APOL2也具有与APOL9相似的拟杆菌目结合能力(图1G)。综上所述,APOL9/2分子与传统的广谱抗菌肽不同, 可能在微生物识别上具有高度的特异性, 为理解宿主–微生物互作机制提供了新的线索。
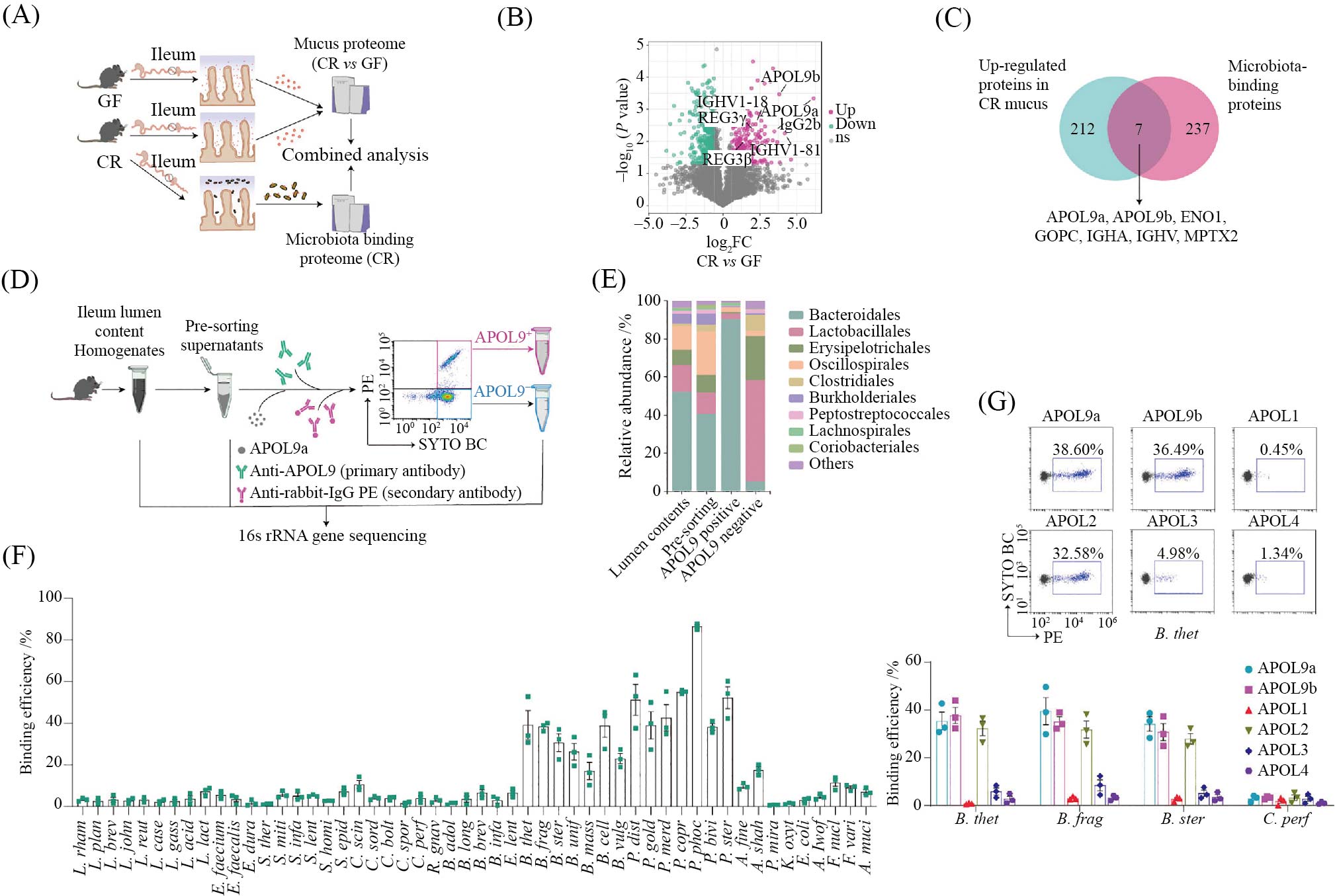
A: 蛋白质组学分析流程示意图。B: 常规饲养小鼠相比无菌小鼠显著上调蛋白。C: 两组独立蛋白质组学数据集之间的交叉对比。D: APOL9测序示意图。E: APOL9结合肠道细菌情况。F: APOL9结合人肠道共生拟杆菌目。G: APOL分子人鼠功能保守性比较。
A: schematic diagram of the proteomics analysis workflow. B: proteins significantly upregulated in CR (conventionally raised) mice compared to GF (germ-free) mice. C: cross-comparison between two independent proteomic datasets. D: schematic representation of APOL9 gene sequencing. E: bacterial binding profile of APOL9. F: APOL9 binds to human commensal Bacteroides. G: comparative analysis of APOL functional conservation between mouse and human.
图1 筛选并鉴定APOL分子主要结合拟杆菌目共生菌(根据参考文献[11]修改)
Fig.1 Screening and identification of APOL proteins primarily targeting Bacteroidales commensal bacteria (modified from reference [11])
3 APOL蛋白的特异性识别依赖细菌特殊的膜脂成分
细菌的外层结构主要由细胞壁和细胞膜组成。依据细胞壁中肽聚糖层的厚度以及是否存在外膜结构, 细菌通常被划分为革兰氏阳性菌和革兰氏阴性菌[17]。拟杆菌, 作为典型的革兰氏阴性菌, 具有特有的外膜结构。我们猜想, APOL9/2蛋白与拟杆菌目细菌之间的特异性结合, 可能依赖于该类细菌独特的外膜成分。查询文献, 我们发现拟杆菌目细菌的一个显著特征是其具有人类同源的丝氨酸–棕榈酰转移酶, 从而具备合成鞘脂的能力[18-19]。与此同时, 已有研究指出, APOL蛋白能够与真核生物细胞膜中的阴离子磷脂结合[20]。因此, 我们推测鞘脂类分子可能是APOL蛋白识别并结合拟杆菌目细菌的关键靶标。为验证这一假设, 我们采用多形拟杆菌(Bacteroides thetaiotaomicron)为代表性的菌株, 通过逐步敲除鞘脂合成通路中的多个关键基因(图2A), 进行了系统性功能筛选。最终, 我们发现神经酰胺激酶(BT_0871)所在通路产物—神经酰胺-1-磷酸(Cer1P)分子, 直接参与了APOL蛋白的结合过程(图2B~图2D)。
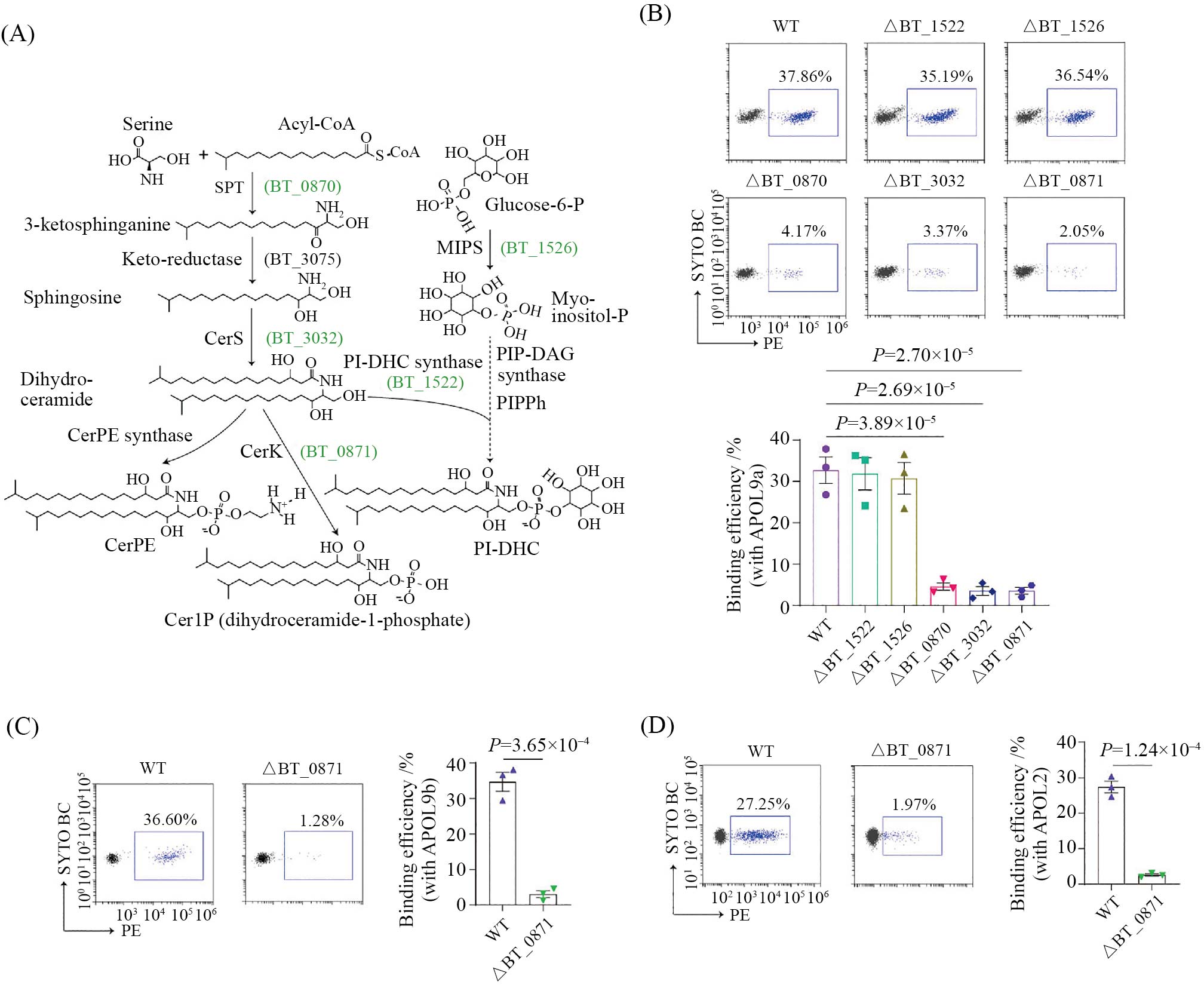
A: 细菌鞘脂合成通路图。B: 对遗传学操作后的细菌进行APOL9a结合能力分析。C、D: 对APOL9b及人源APOL2进行结合能力分析表明APOL功能跨物种保守。
A: diagram of the bacterial sphingolipid biosynthesis pathway. B: analysis of APOL9A binding ability to genetically modified bacteria. C,D: binding assays with APOL9B and human-derived APOL2 demonstrate functional conservation of APOL across species.
图2 APOL分子通过Cer1P结合拟杆菌目(根据参考文献[11]修改)
Fig.2 APOL proteins bind Bacteroidales via Cer1P (modified from reference [11])
4 APOL蛋白不杀伤细菌而是诱导外膜囊泡生成
先前研究表明, APOL分子具有典型的穿膜打孔结构域, 参与宿主对病原微生物的清除[21-22]。在本研究中, 我们通过流式细胞术和免疫共沉淀实验进一步验证了APOL分子能够直接结合拟杆菌目细菌表面的神经酰胺-1-磷酸(Cer1P)分子。然而, 这种结合是否会引发类似抗菌肽的杀菌效应, 进而导致细菌死亡, 尚不清楚。为回答这一问题, 我们首先比较了APOL9缺失小鼠与野生型小鼠肠腔及黏液层中的细菌群落组成。结果出人意料地发现, APOL9缺失并未显著改变拟杆菌目细菌的丰度(图3A)。此外,体外培养实验也显示, APOL9的存在并不影响多形拟杆菌的生长速率(图3B), 提示其对细菌的直接杀伤作用有限。
为进一步探索APOL分子结合后的细菌生理变化, 我们采用透射电子显微镜(transmission electron microscope, TEM)观察多形拟杆菌在处理APOL蛋白后的超微结构变化。结果发现, APOL处理显著诱导了外膜囊泡(outer membrane vesicles, OMVs)的释放(图3C), 在细菌培养上清中亦可检测到大量囊泡生成(图3D)。而当敲除Cer1P合成关键酶BT0871后, 这一现象不再出现, 提示Cer1P在囊泡诱导中发挥关键作用。类似的现象也在其他拟杆菌目细菌中被观察到(图3E和图3F); 而对于结合能力较弱的菌株, 如大肠杆菌, APOL分子并不诱导显著的囊泡释放。
综上所述, APOL分子不同于传统抗菌肽, 其并不直接杀灭细菌, 而是通过结合Cer1P诱导细菌发生膜应激反应, 促进外膜囊泡的释放。这一机制提示APOL可能在宿主–微生物互作中发挥独特的调节作用, 而非单纯的抗菌效应。
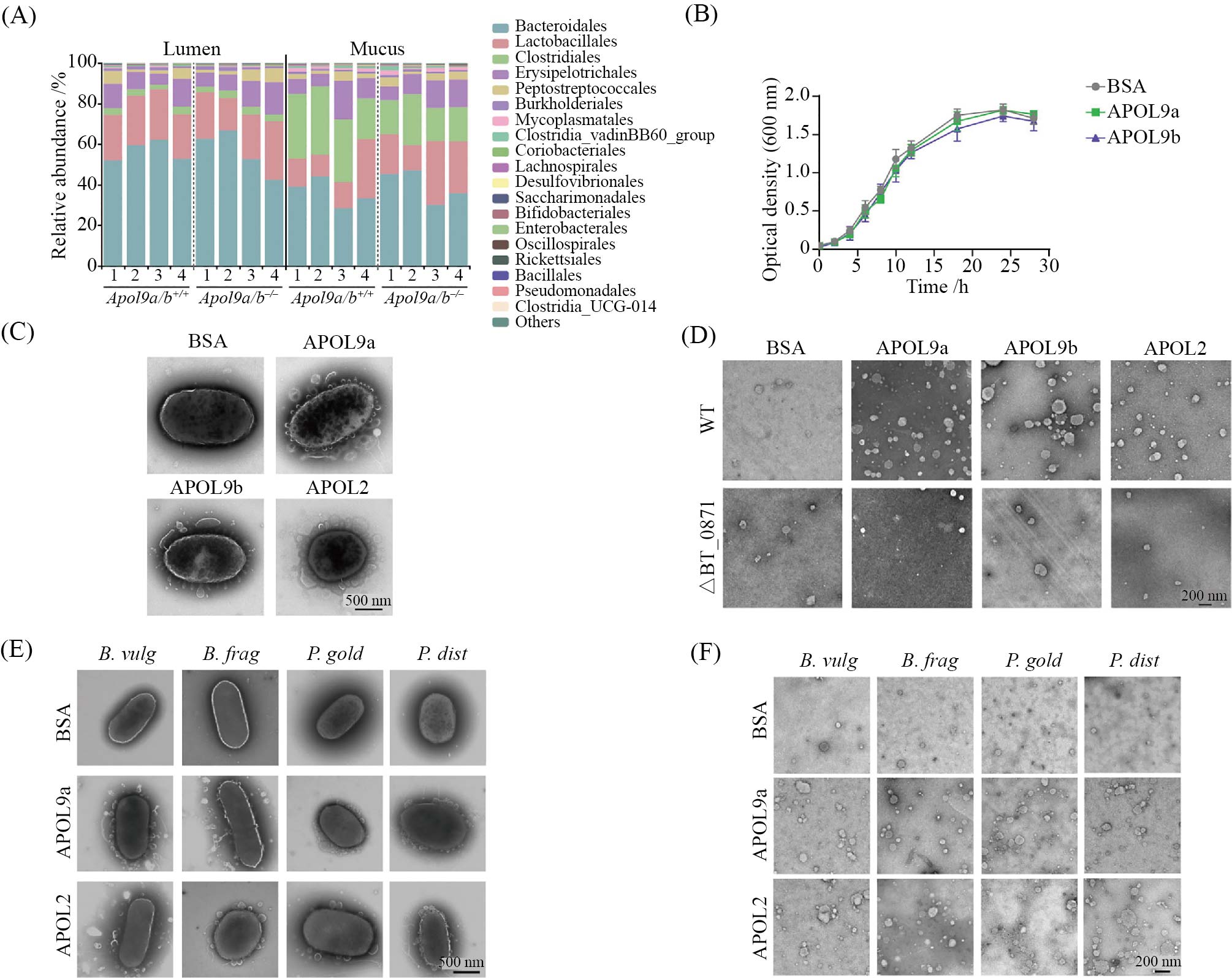
A: APOL9缺失小鼠与野生型小鼠小肠16S rRNA测序结果。B: APOL分子处理条件下多形拟杆菌生长情况。C: APOL分子处理多形拟杆菌。D:离心获得的细菌培养基上清。E: APOL分子处理多个拟杆菌目细菌。F: 图E处理后的细菌培养基上清。
A: 16S rRNA sequencing of the small intestine microbiota in APOL9-deficient and wild-type mice. B: growth of Bacteroides thetaiotaomicron under APOL protein treatment conditions. C: treatment of Bacteroides thetaiotaomicron with APOL proteins. D: supernatant collected from centrifuged bacterial cultures. E: APOL protein treatment of multiple Bacteroidales species. F: supernatant from bacterial cultures treated as shown in panel E.
图3 APOL分子靶向拟杆菌目细菌促进其释放OMVs(根据参考文献[11]修改)
Fig.3 APOL proteins target Bacteroidales to promote the release of OMVs (modified from reference [11])
5 外膜囊泡通过多细胞作用促进上皮细胞MHC-II表达
OMVs是细菌与宿主免疫系统沟通的重要介质,具有激活、调节乃至“培训”免疫系统的多重功能[23-25]。那APOL9介导的拟杆菌目细菌释放的外膜囊泡在宿主免疫稳态中究竟具有什么作用?
为探究该问题, 我们对稳态条件下APOL9缺失小鼠回肠上皮细胞(intestinal epithelial cells, IECs)进行了转录组分析。结果显示, APOL9缺失显著下调了主要组织相容性复合体II类分子(major histocompatibility complex class II, MHC-II)的表达(图4A)。这一转录水平的变化, 随后通过荧光定量PCR和流式细胞术实验得到了进一步验证(图4B和图4C), 表明APOL9对肠道上皮细胞MHC-II的表达具有正向调控作用。考虑到APOL9可诱导OMVs释放, 而OMVs在免疫调节中发挥重要作用, 我们进一步推测: APOL9缺失引起的MHC-II下调是否与细菌来源OMVs数量减少有关?为验证这一假设, 我们向APOL9缺失小鼠口服补充多形拟杆菌来源的OMVs(图4D)。结果发现, 经OMVs补充处理后, 这些小鼠的回肠干扰素γ(interferon-γ, IFN-γ)水平和上皮细胞MHC-II表达水平恢复至接近野生型小鼠的水平(图4E和图4F)。
综上所述, 我们的研究表明, APOL9通过诱导拟杆菌目细菌释放OMVs, 促进肠上皮细胞MHC-II的表达, 从而可能在维持肠道黏膜免疫稳态中发挥关键作用。
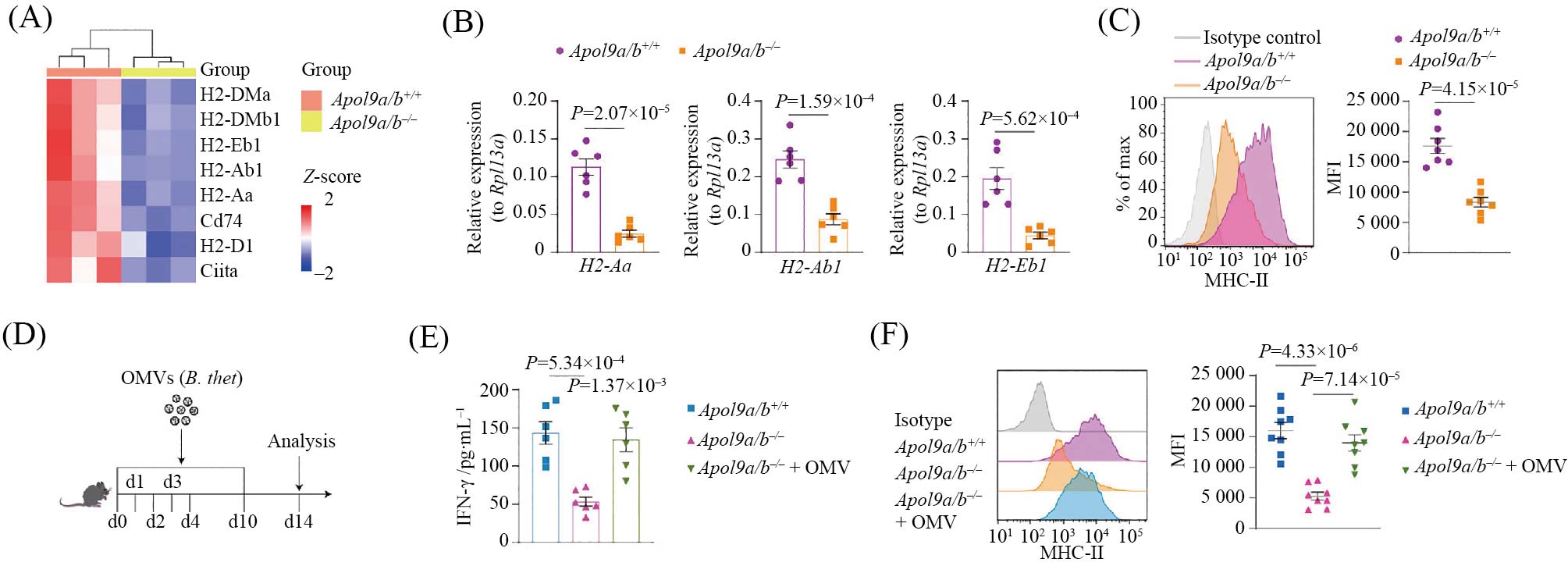
A: 转录组分析显示APOL9缺失小鼠与野生型小鼠的基因表达差异。B、C: 荧光定量PCR和流式细胞术进一步验证测序结果。D: 小鼠进行外膜囊泡口服给药示意图。E: 回补OMVs后检测体内干扰素γ水平。F: 流式细胞术检测回补实验后上皮细胞MHC-II表达情况。
A: transcriptomic analysis reveals differential gene expression between APOL9-deficient and wild-type mice. B,C: validation of sequencing results via qPCR and flow cytometry. D: schematic diagram of oral administration of OMVs (outer membrane vesicles) in mice. E: detection of IFN-γ levels after OMV supplementation. F: flow cytometry analysis of MHC-II expression in epithelial cells after OMV supplementation.
图4 OMVs口服给药促进上皮细胞MHC-II的表达(根据参考文献[11]修改)
Fig.4 Oral administration of OMVs promotes MHC-II expression in intestinal epithelial cells (modified from reference [11])
6 体内APOL9分子可以调节上皮内淋巴细胞发育并增强抗细菌感染能力
作为肠道黏膜的第一道屏障, 上皮细胞不仅承担着物理防御和营养吸收的基本功能, 还在调节黏膜免疫反应中发挥积极作用。其中, 主要组织相容性复合体II类分子(MHC-II)的表达, 使肠上皮细胞具备与免疫系统直接交流的能力, 在维持肠道免疫稳态中具有重要意义[26]。为进一步探究APOL9缺失导致回肠上皮细胞MHC-II下调对肠道免疫系统的影响, 我们对野生型与APOL9缺失小鼠回肠上皮内CD45⁺免疫细胞进行了单细胞转录组测序分析。结果显示, APOL9缺失并不显著改变免疫细胞的整体组成, 但会显著减少CD4⁺CD8αα⁺肠上皮内淋巴细胞(intraepithelial lymphocytes, IELs)的数量(图5A和图5B)。该现象随后通过流式细胞术得到了进一步验证(图5C)。
CD4⁺CD8αα⁺ IELs已被广泛认为兼具细胞毒性与免疫调节功能, 在维持肠道免疫耐受、促进屏障修复以及应对病原感染中具有关键作用[27-28]。在后续沙门氏菌感染实验中, 我们发现APOL9缺失小鼠对感染更加敏感, 表现出更高的死亡率和更严重的病理变化(图5D)。进一步地, 当我们向APOL9缺失小鼠回补拟杆菌来源的OMVs后, 其回肠上皮内CD4⁺CD8αα⁺ IELs数量恢复至正常水平, 并表现出与野生型小鼠相似的抗感染能力。组织学分析及对肝脏和脾脏细菌负载的检测均支持这一结果(图5D)。
综上所述, APOL9通过诱导细菌OMVs的产生, 进而调节上皮细胞MHC-II表达, 维持CD4⁺CD8αα⁺ IELs稳态, 从而在肠道感染过程中发挥免疫保护作用。
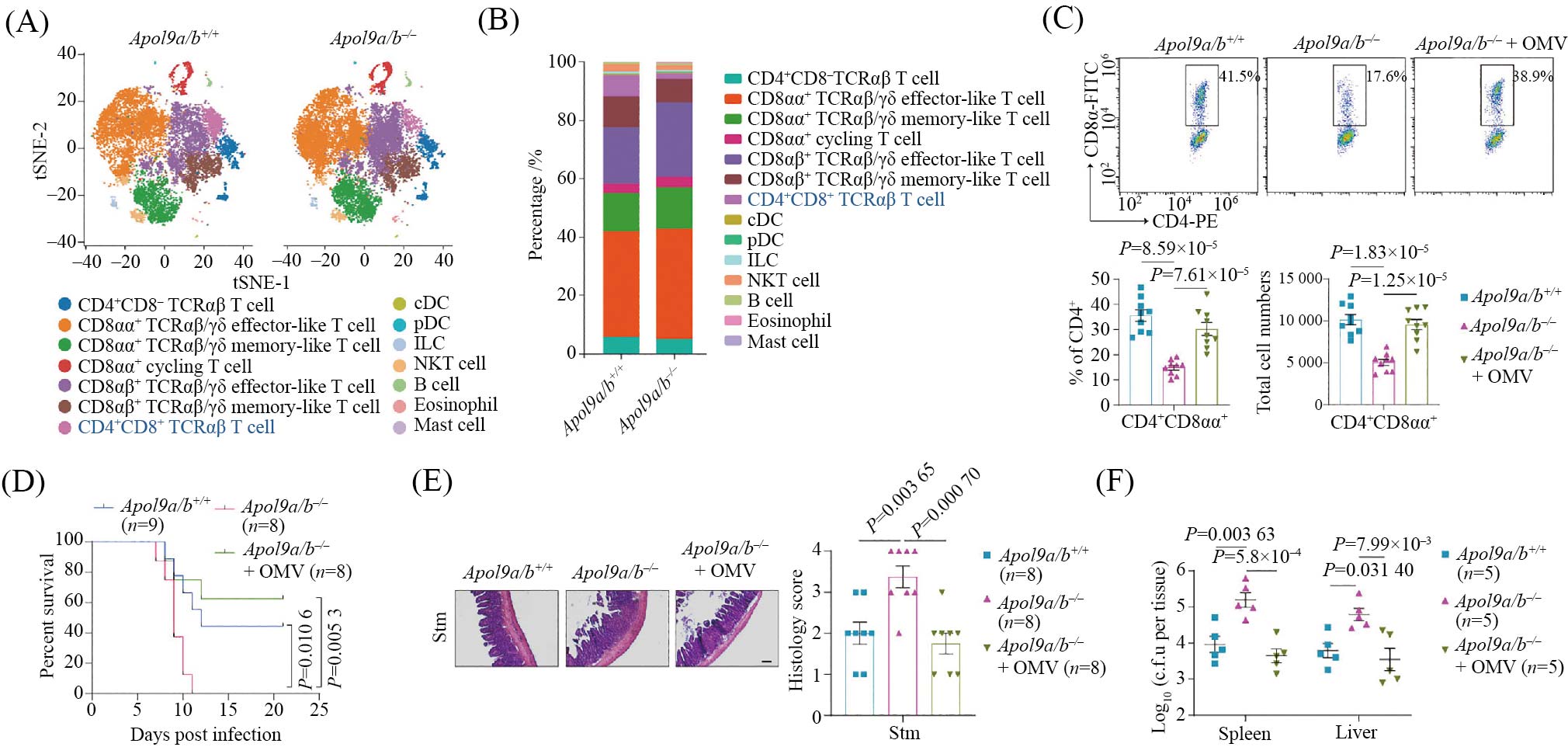
A、B: 单细胞测序技术鉴定免疫细胞组成比例差异。C: 流式细胞术检测OMVs口服给药后免疫细胞占比。D: OMVs口服给药增强APOL9缺失小鼠对沙门氏菌感染的抵抗能力。E: 组织学染色及统计结果。F: 小鼠沙门氏菌感染后脾脏和肝脏的细菌负载。
A,B: single-cell RNA sequencing reveals differences in the proportions of immune cell populations. C: flow cytometry analysis of immune cell composition following oral administration of OMVs. D: oral delivery of OMVs enhances resistance to Salmonella infection in APOL9-deficient mice. E: histological staining and corresponding quantification of intestinal inflammation. F: bacterial loads in the spleen and liver after Salmonella infection in mice.
图5 OMVs口服给药促进CD4+CD8αα+细胞发育并抵抗细菌感染(根据参考文献[11]修改)
Fig.5 Oral administration of OMVs facilitates the development of CD4⁺CD8αα⁺ cells and enhances resistance to bacterial infection (modified from reference [11])
7 总结与展望
本研究首次揭示宿主可通过载脂蛋白L家族成员APOL9a/b特异性识别肠道共生菌膜上的Cer1P分子, 从而精准调控拟杆菌目等共生菌的行为。这种选择性识别机制不同于传统的广谱免疫屏障机制, 它展现出宿主在长期共生演化中形成的高度适应性策略。APOL分子可特异性识别并靶向细菌, 但不直接介导细菌的杀伤作用, 相反可以有效引导共生菌释放OMVs以激活宿主保护性免疫通路, 特别是增强肠上皮细胞MHC-II表达水平, 进而支持肠道CD4+CD8αα+ IELs的发育和功能, 维持局部免疫稳态。
本研究深化了我们对宿主–微生物共生机制的理解, 也为宿主如何借助分子特异性手段塑造免疫生态提供了范式。特别是在炎症性肠病、感染性腹泻及免疫相关疾病日益高发的背景下, 该机制提供了干预共生菌功能的新思路。此外, 该研究还揭示了APOL蛋白在人类肠道中的潜在保守性功能, 提示了其在精准调节人类肠道免疫中也可能发挥类似作用。
未来研究可进一步探讨: (1) APOL2及其他人源APOL家族成员是否也能特异性识别Cer1P并调节肠道免疫; (2) OMVs在不同免疫微环境中的功能差异及靶向作用机制; (3) 如何基于APOL-OMV轴开发微生态治疗策略, 如个性化菌群管理、基于OMV的免疫调节剂或肠道疫苗。总体而言, 本研究为建立“以宿主为主导、以共生菌为目标”的精准微生态干预路径奠定了坚实的理论基础。
参考文献 (References)
[1] KRAUTKRAMER K A, FAN J, BÄCKHED F. Gut microbial metabolites as multi-kingdom intermediates [J]. Nat Rev Microbiol, 2021, 19(2): 77-94.
[2] ARPAIA N, CAMPBELL C, FAN X, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation [J]. Nature, 2013, 504(7480): 451-5.
[3] SMITH P M, HOWITT M R, PANIKOV N, et al. The microbial metabolites, short-chain fatty acids, regulate colonic treg cell homeostasis [J]. Science, 2013, 341(6145): 569-73.
[4] HANG S, PAIK D, YAO L, et al. Bile acid metabolites control TH17 and Treg cell differentiation [J]. Nature, 2019, 576(7785): 143-8.
[5] SONG X, SUN X, OH S F, et al. Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis [J]. Nature, 2020, 577(7790): 410-5.
[6] CAMPBELL C, MCKENNEY P T, KONSTANTINOVSKY D, et al. Bacterial metabolism of bile acids promotes generation of peripheral regulatory T cells [J]. Nature, 2020, 581(7809): 475-9.
[7] KAYAMA H, TAKEDA K. Polysaccharide A of Bacteroides fragilis: actions on dendritic cells and T cells [J]. Mol Cell, 2014, 54(2): 206-7.
[8] MUKHERJEE S, HOOPER LORA V. Antimicrobial defense of the intestine [J]. Immunity, 2015, 42(1): 28-39.
[9] PETERSON L W, ARTIS D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis [J]. Nat Rev Immunol, 2014, 14(3): 141-53.
[10] WU M, ZHENG W, SONG X, et al. Gut complement induced by the microbiota combats pathogens and spares commensals [J]. Cell, 2024, 187(4): 897-913,e18.
[11] YANG T, HU X, CAO F, et al. Targeting symbionts by apolipoprotein L proteins modulates gut immunity [J]. Nature, 2025, doi: 10.1038/s41586-025-08990-4.
[12] PAONE P, CANI P D. Mucus barrier, mucins and gut microbiota: the expected slimy partners [J]? Gut, 2020, 69(12): 2232-43.
[13] SCHROEDER B O. Fight them or feed them: how the intestinal mucus layer manages the gut microbiota [J]. Gastroenterol Rep, 2019, 7(1): 3-12.
[14] HOOPER L V, WONG M H, THELIN A, et al. Molecular analysis of commensal host-microbial relationships in the intestine [J]. Science, 2001, 291(5505): 881-4.
[15] CASH H L, WHITHAM C V, BEHRENDT C L, et al. Symbiotic bacteria direct expression of an intestinal bactericidal lectin [J]. Science, 2006, 313(5790): 1126-30.
[16] WANG Y, SONG W, WANG J, et al. Single-cell transcriptome analysis reveals differential nutrient absorption functions in human intestine [J]. J Exp Med, 2019, 217(2): e20191130.
[17] KRIEG N R. Bacterial classification: an overview [J]. Can J Microbiol, 1988, 34(4): 536-40.
[18] BROWN E M, KE X, HITCHCOCK D, et al. Bacteroides-derived sphingolipids are critical for maintaining intestinal homeostasis and symbiosis [J]. Cell Host Microbe, 2019, 25(5): 668-80,e7.
[19] JOHNSON E L, HEAVER S L, WATERS J L, et al. Sphingolipids produced by gut bacteria enter host metabolic pathways impacting ceramide levels [J]. Nat Commun, 2020, 11(1): 2471.
[20] UZUREAU S, LECORDIER L, UZUREAU P, et al. APOL1 Cterminal variants may trigger kidney disease through interference with APOL3 control of actomyosin [J]. Cell Rep, 2020, 30(11): 3821-36,e13.
[21] PÉREZ-MORGA D, VANHOLLEBEKE B, PATURIAUX-HANOCQ F, et al. Apolipoprotein L-I promotes trypanosome lysis by forming pores in lysosomal membranes [J]. Science, 2005, 309(5733): 469-72.
[22] THOMSON R, FINKELSTEIN A. Human trypanolytic factor APOL1 forms pH-gated cation-selective channels in planar lipid bilayers: relevance to trypanosome lysis [J]. Proc Natl Acad Sci USA, 2015, 112(9): 2894-9.
[23] STEFAN K L, KIM M V, IWASAKI A, et al. Commensal microbiota modulation of natural resistance to virus infection [J]. Cell, 2020, 183(5): 1312-24,e10.
[24] YANG D, CHEN X, WANG J, et al. Dysregulated lung commensal bacteria drive interleukin-17B production to promote pulmonary fibrosis through their outer membrane vesicles [J]. Immunity, 2019, 50(3): 692-706,e7.
[25] SHEN Y, TORCHIA MARIA LETIZIA G, LAWSON GREGORY W, et al. Outer membrane vesicles of a human commensal mediate immune regulation and disease protection [J]. Cell Host Microbe, 2012, 12(4): 509-20.
[26] HEUBERGER C, POTT J, MALOY K J. Why do intestinal epithelial cells express MHC class II [J]? Immunology, 2021, 162(4): 357-67.
[27] LOCKHART A, MUCIDA D, BILATE A M. Intraepithelial lymphocytes of the intestine [J]. Annu Rev Immunol, 2024, 42: 289-316.
[28] SONG X, ZHANG H, ZHANG Y, et al. Gut microbial fatty acid isomerization modulates intraepithelial T cells [J]. Nature, 2023, 619(7971): 837-43.



 中文版
中文版 英文版
英文版