领域前沿·中国
新型肠道间质细胞MRISC调控炎症过程中肠道干细胞的损伤修复
伍宁波 孙宏翔 谭剑美 苏冰*
(上海交通大学医学院, 上海市免疫学研究所, 上海 200025)
| 苏冰, 上海交通大学医学院上海市免疫学研究所所长, 上海市免疫学研究所研究员, 上海交通大学医学院免疫学与微生物学系主任, 上海市免疫学研究所免疫与微生态相关疾病研究中心主任, 上海交通大学医学院–耶鲁免疫代谢研究院主任。1984年毕业于北京大学, 获得理学学士学位。1987、1991年在美国耶鲁大学分别获得硕士和博士学位。1991—1995年在美国加州大学圣地亚哥分校从事博士后研究工作。1995—2006年在美国德克萨斯大学/MD安德森癌症中心任助理教授、副教授、教授。2007—2014年在美国耶鲁大学医学院免疫生物学/血管生物学/移植研究系任副教授。2012年加入上海交通大学医学院, 担任上海市免疫学研究所所长。苏冰教授长期致力于细胞信号转导研究, 尤其是MAPK和mTOR信号通路的调控机制及免疫调控作用, 取得了一系列原创性科学发现, 在Cell、Nature、Nature Genetics、Nature Immunology、Immunity等杂志上发表论文90余篇, 他引超过14 000次。近年来苏冰教授聚焦于肠道黏膜免疫和炎症相关疾病的基础研究, 并与瑞金医院、仁济医院等临床科室合作开展临床转化研究。 |
新型肠道间质细胞MRISC调控炎症过程中
肠道干细胞的损伤修复
伍宁波 孙宏翔 谭剑美 苏冰*
(上海交通大学医学院, 上海市免疫学研究所, 上海 200025)
[摘要] 炎症和损伤能迅速激发肠道干细胞增殖促进组织修复再生。肠道微环境组分中的重要成员—肠道间质细胞在这个过程中起到了非常重要的调控作用。近年来, 随着单细胞测序技术的快速发展, 研究人员揭示了肠道间质细胞是一类异常复杂且具高度异质性的细胞群。目前, 领域内对不同肠道间质细胞亚群的基因特征、空间分布、潜在功能以及调节的细胞和分子机制仍知之甚少。该文总结了该团队发现肠道间质细胞新亚群MRISC(MAP3K2-regulated intestinal stromal cell)的过程, 并详细描述了MRISC在肠道炎症和损伤过程中通过特异调控肠道干细胞微环境的R-spondin1-Wnt信号参与肠道上皮组织损伤修复的作用和机理, 为MAPK信号在肠道疾病研究和治疗中的应用提供了新思路。
[关键词] 肠道间质细胞; 肠道干细胞微环境; MRISC; R-spondin1
Novel Intestinal Mesenchymal Stromal Cell MRISC Regulates Intestinal Stem Cell upon Damage-Induced
Tissue Repair and Inflammation
WU Ningbo, SUN Hongxiang, TAN Jianmei, SU Bing*
(Shanghai Institute of Immunology, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China)
[Abstract] Inflammation and tissue damage could rapidly stimulate intestinal stem cell proliferation and promote tissue regeneration. Intestinal mesenchymal stromal cell, one of the key components of intestinal micro-environment, plays an essential regulatory role in this process. With the advancement of single cell sequencing technologies, researchers revealed intestinal mesenchymal stromal cells as a complex and highly heterogeneous cell population. Currently, the gene signature, spatial distribution, potential function, cellular and molecular regulatory mechanisms of these distinctive stromal cell populations are still poorly understood. This paper revisited the course of MRISC (MAP3K2-regulated intestinal stromal cell) discovery, and described the role and mechanism of MRISC involved in intestinal epithelial repair by specifically regulating the R-spondin1-Wnt signal of the intestinal stem cell niche during intestinal inflammation and injury. This work provided new insights in application of MAPK signal
perturbation to the research and therapies of intestinal diseases.
[Keywords] intestinal stromal cell; intestinal stem cell niche; MRISC; R-spondin1
肠道受到损伤和产生炎症时, 肠道上皮干细胞能迅速作出响应启动增殖分化过程以促进组织修复再生[1]。肠道间质细胞紧密连接着上皮细胞, 是肠道微环境组分中的重要成员, 在上皮细胞中起到支撑的作用。在FGF、TGF-β、Hedgehog与PDGF等信号调控下, 肠道间质细胞可分化为多种复杂群体, 它们通过与淋巴细胞、髓系细胞、上皮细胞和神经细胞的相互作用, 协同调控肠道上皮干细胞的功能以维持肠道稳态[2-3]。
借助谱系示踪技术, 肠道间质细胞的功能异质性正在逐步被阐明。不同的肠道间质细胞群体通过分泌相应的生长因子与细胞因子可有效调节肠道结构完整性与稳态。然而, 研究人员至今仍然不清楚这些新发现的肠道间质细胞群体在肠道稳态维持与疾病条件下, 通过何种机制精确调控着肠道功能。得益于单细胞测序技术的快速发展, 研究人员认识到肠道间质细胞是一大类复杂且具有高度异质性的细胞[4]。Foxl1+特洛细胞[5]及CD81+滋养细胞[6]的发现, 提示肠道可能存在多种不同分化方向或状态且功能特异的肠道间质细胞亚群。目前领域内对不同肠道间质细胞亚群的特征、空间分布、在组织损伤修复中的潜在功能以及调节的细胞和分子机制知之甚少。因此, 对新型肠道间质细胞亚群的身份鉴定
上游刺激信号的发现以及转录和表观遗传调控通路的阐明已成为间质细胞领域最基础和重要的科学问题。
MAP3K2是在进化上保守的苏/丝氨酸蛋白激酶, 在许多组织和器官中组成性表达, 可以响应多种生长信号和应激信号, 调节细胞的增殖、分化等过程[7-8]。我们检测发现, MAP3K2在肠道组织中表达非常高。利用DSS诱导的小鼠肠炎模型, 我们发现, MAP3K2缺失会造成肠炎加重的表型。进一步检测发现, MAP3K2缺失导致肠道LGR5+干细胞减少。这提示, MAP3K2可能通过维持损伤状态下肠道中LGR5+干细胞的数量和功能起到关键的肠炎保护作用。
为了阐明MAP3K2究竟影响了何种细胞, 从而造成小鼠肠炎加重, 我们首先采取了骨髓移植后再进行DSS处理观察肠炎严重程度的方法, 证明了MAP3K2在非骨髓来源细胞中的作用是导致敲除型小鼠肠炎加重的原因。随后, 我们构建了Map3k2条件性敲除小鼠, 和Vil1-Cre小鼠杂交, 得到上皮特异性敲除小鼠。结果有些意外, 肠道上皮细胞中的MAP3K2信号并不能介导肠炎保护作用。在排除了免疫细胞和上皮细胞的作用后, 我们最终利用Col1a2-CreERT2小鼠在gp38+的基质细胞中特异性敲除Map3k2, 证明了gp38+基质细胞中的MAP3K2信号介导了肠炎保护作[9]。
为了探究基质细胞中MAP3K2信号通过何种分子机制影响肠道干细胞功能, 我们对野生型和敲除型小鼠正常条件下和DSS处理的结肠组织进行转录组测序分析。我们重点分析了对于肠道干细胞增殖和分化有重要作用的信号通路, 如Notch、EGF和Wnt信号通路[10-11]。我们发现, 敲除型小鼠结肠内Notch信号通路和EGF信号通路没有明显区别, 但是DSS诱导的肠炎早期, Wnt信号通路的激活程度较野生型明显下降。这提示, MAP3K2可能通过调节损伤情况下肠道干细胞Wnt信号的活化强度来促进上皮的损伤修复。通过进一步仔细分析Wnt通路各部分基因的表达, 我们找到了一个非常重要的Wnt信号调控分子R-spondin1。R-spondin1可以结合表达在肠道干细胞表面的LGR5分子, 阻止Wnt受体的降解, 从而持续激活Wnt信号, 这对肠道干细胞维持自我更新及分化有着重要作用[12-13]。我们的测序结果显示, Map3k2敲除肠炎小鼠结肠中R-spondin1表达下降, 这提示我们在炎症损伤条件下, MAP3K2可能通过调控肠道间质细胞产生的R-spondin1来激活肠道干细胞的Wnt信号从而促进损伤修复[9]。
为了验证R-spondin1对肠道上皮细胞的作用, 我们在DSS诱导肠炎的同时腹腔注射重组R-spondin1, 结果发现, 补充R-spondin1可以显著减轻Map3k2敲除型小鼠的肠炎严重程度, 且其上皮干细胞标志物Lgr5表达量也显著上升。我们进一步借助肠道原位注射手术, 将重组R-spondin1递送至结肠黏膜下层, 结果显示, Map3k2敲除型小鼠结肠接受重组R-spondin1后Lgr5表达水平与野生型相当, 进一步验证了MAP3K2是通过影响R-spondin1的产生来调控肠道上皮细胞的损伤修复[9]。
目前, 已知R-spondin1主要由肠道间质细胞分泌[14]。然而, 肠道间质细胞具有高度异质性, R-spondin1具体来源于何种间质细胞尚不清楚。有研究报道, 在体外培养CD90+间质细胞能促进肠道干细胞的生长和分化, 但具体机制尚不清楚[15]。我们分选出CD326+结肠上皮细胞、CD45+免疫细胞、CD90–间质细胞和CD90+间质细胞, 用qRT-PCR检测Rspo1基因的表达。我们发现, R-spondin1主要表达在CD90+间质细胞。在DSS处理之后, 在野生型CD90+间质细胞中R-spondin1的表达显著上升, 而在Map3k2敲除的CD90+间质细胞中的表达却没有变化。这些结果说明, MAP3K2影响了肠道CD90+间质细胞中R-spondin1的产生[9]。
CD90仍然是一个间质细胞表达较为广泛的分子。为了更好地阐明CD90+间质细胞的特征和功能, 我们分选了CD90+间质细胞进行单细胞测序。我们发现, CD90+间质细胞中包含了9个不同的基质细胞亚群。其中间皮细胞、Cluster 2和Cluster 5高表达R-spondin1, 考虑到间皮细胞位于肠腔最外侧远离隐窝干细胞所在的位置[16], 我们将重点放在Cluster 2和Cluster 5两群间质细胞上。通过差异基因分析, 我们发现, Cluster 5高表达CD34和CD81分子, 不表达CD138分子。而Cluster2不表达CD34和CD81分子, 高表达CD138分子。我们用流式的方法分选了这两群细胞, 然后检测R-spondin1表达, 最终确认只有Cluster 5中R-spondin1的表达受到了MAP3K2的调控, 因此, 我们把这群新细胞命名为MRISC(MAP3K2-regulated intestinal stromal cell)[9]。
为了验证MRISC具有维持肠道干细胞的功能, 我们采用流式细胞术分选了MRISC, 通过与肠道类器官共培养以及肠道原位细胞注射实验, 我们在体外和体内实验中证明了MRISC通过MAP3K2调节R-spondin1信号, 促进肠道干细胞的增殖和修复功能。同时, 为了找到这群细胞在肠道中的位置, 我们构建了Rspo1-tdTomato荧光报告小鼠。利用此小鼠, 结合CD34和CD81的免疫荧光染色, 我们发现, MRISC特异性地位于肠道隐窝底部的肠道干细胞周围(图1A)[9]。
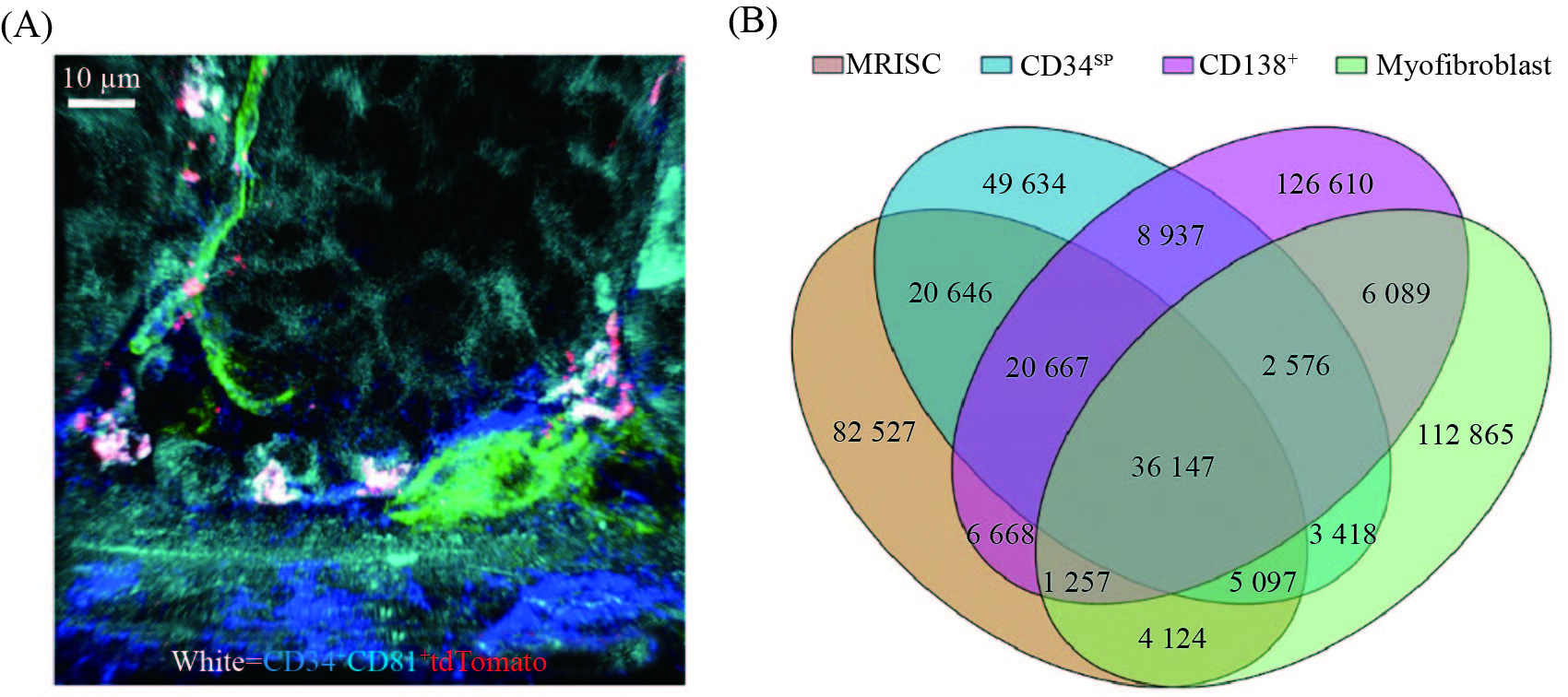
A: 免疫荧光染色显示, MRISC(CD34+CD81+tdTomato+)(白色)位于肠道隐窝干细胞底部; B: 维恩图显示, 小鼠结肠MRISC具有与CD34SP间质细胞、CD138+间质细胞以及Myofibroblast不同的染色体开放区域。
A: image showed that MRISC (CD34+CD81+tdTomato+) (white) was located at the bottom of intestinal stem cells; B: Venn diagram showed that the MRISC of mouse colon had different chromosomal open regions compared with CD34SP stromal cells, CD138+ stromal cells and myofibroblast.
图1 MRISC具有独特的位置和表观遗传特征(根据参考文献[9]修改)
Fig.1 MRISC has unique location and epigenomic features (modified from reference [9])
为进一步研究MAP3K2特异调控新型肠道间质细胞MRISC中R-spondin1表达的分子机制并探索其表观遗传的特征, 我们分选了MRISC和其他几种主要的肠道间质细胞, 进行ATAC-Seq测序分析。结果显示, MRISC有着与其他间质细胞非常不同的表观遗传调控特征(图1B), 并发现MRISC的核心转录调控因子KLF2直接受MAP3K2信号调控。我们在体外实验中进一步发现了“活性氧(reactive oxygen species, ROS)-MAP3K2-ERK5-KLF2”这一全新的诱导R-spondin1产生的分子通路[9]。
我们课题组长期聚焦于MAP3K2的功能研究, 目前的研究发现不同细胞的MAP3K2信号对于肠道稳态平衡发挥着不同的作用。在此项研究中, MRISC中的MAP3K2信号通过调节R-spondin1-Wnt通路, 促进肠道损伤修复, 降低肠道炎症反应。而我们另一项研究显示, 在肠道T细胞中MAP3K2可以激活JNK促进肠道IL-18诱导的Th1细胞分化, 促进T细胞介导的肠炎反应[8]。而在巨噬细胞研究方面, 安华章教授团队[7]研究证实, MAP3K2是TLR9信号通路中ERK1/2活化的关键因子, 在促进巨噬细胞炎症细胞因子生成中发挥了重要作用[17]。此外, MAP3K2有一个同源性非常高的MAP3K家族分子—MAP3K3, 两者结构具有71%的同源性, 其催化结构域的同源性高达95%, 它们在细胞中的功能存在一定的互补性。在间质细胞中, MAP3K3表达很低, 因此主要由MAP3K2发挥调控功能。而在我们之前的研究中, MAP3K3在血管内皮细胞中表达很高, 发挥了调控胚胎心血管系统的早期发育[18]和维持血管屏障[19]的功能。而在T细胞中, MAP3K2与MAP3K3表达都很高, 两者一起调节ERK1/2的激活, 抑制Treg和Th7细胞的分化[7]。因此, 在临床治疗中, 结合MAP3K2与MAP3K3的表达情况, 寻找细胞特异性的MAP3K通路抑制剂可能会对肠炎的治疗更加有效。
参考文献 (References)
[1] BARKER N, VAN ES J H, KUIPERS J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5 [J]. Nature, 2007, 449(7165): 1003-7.
[2] MCCARTHY N, KRAICZY J, SHIVDASANI R A. Cellular and molecular architecture of the intestinal stem cell niche [J]. Nat Cell Biol, 2020, 22(9): 1033-41.
[3] POWELL D W, PINCHUK I V, SAADA J I, et al. Mes-enchymal cells of the intestinal lamina propria [J]. Annu Rev Physiol, 2011, 73: 213-37.
[4] KINCHEN J, CHEN H H, PARIKH K, et al. Structural remodeling of the human colonic mesenchyme in inflammatory bowel disease [J]. Cell, 2018, 175(2): 372-86,e17.
[5] SHOSHKES-CARMEL M, WANG Y J, WANGENSTEEN K J, et al. Subepithelial telocytes are an important source of Wnts that supports intestinal crypts [J]. Nature, 2018, 557(7704): 242-6.
[6] MCCARTHY N, MANIERI E, STORM E E, et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient [J]. Cell Stem Cell, 2020, 26(3): 391-402,e5.
[7] CHANG X, LIU F, WANG X, et al. The kinases MEKK2 and MEKK3 regulate transforming growth factor-beta-mediated helper T cell differentiation [J]. Immunity, 2011, 34(2): 201-12.
[8] WU N, CHEN D, SUN H, et al. MAP3K2 augments Th1 cell differentiation via IL-18 to promote T cell-mediated colitis [J]. Sci China Life Sci, 2020, doi: 10.1007/s11427-020-1720-9.
[9] WU N, SUN H, ZHAO X, et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche [J]. Nature, 2021, 592(7855): 606-10.
[10] BARKER N. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration [J]. Nat Rev Mol Cell Biol, 2014, 15(1): 19-33.
[11] SATO T, VRIES R G, SNIPPERT H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche [J]. Nature, 2009, 459(7244): 262-5.
[12] KIM K A, KAKITANI M, ZHAO J, et al. Mitogenic influence of human R-spondin1 on the intestinal epithelium [J]. Science, 2005, 309(5738): 1256-9.
[13] DE LAU W, BARKER N, LOW T Y, et al. Lgr5 homologues as sociate with Wnt receptors and mediate R-spondin signalling [J]. Nature, 2011, 476(7360): 293-7.
[14] STZEPOURGINSKI I, NIGRO G, JACOB J M, et al. CD34+ mesenchymal cells are a major component of the intestinal stem cells niche at homeostasis and after injury [J]. Proc Natl Acad Sci USA, 2017, 114(4): E506-13.
[15] LAHAR N, LEI N Y, WANG J, et al. Intestinal subepithelial myofibroblasts support in vitro and in vivo growth of human small intestinal epithelium [J]. PLoS One, 2011, 6(11): e26898.
[16] KANAMORI-KATAYAMA M, KAIHO A, ISHIZU Y, et al. LRRN4 and UPK3B are markers of primary mesothelial cells [J].PLoS One, 2011, 6(10): e25391.
[17] WEN M, MA X, CHENG H, et al. Stk38 protein kinase pre-ferentially inhibits TLR9-activated inflammatory responses by promoting MEKK2 ubiquitination in macrophages [J]. Nat Commun, 2015, 6: 7167.
[18] YANG J, BOERM M, MCCARTY M, et al. Mekk3 is essential for early embryonic cardiovascular development [J]. Nat Genet, 2000, 24(3): 309-13.
[19] FISHER O S, DENG H, LIU D, et al. Structure and vascular function of MEKK3-cerebral cavernous malformations 2 complex [J]. Nat Commun, 2015, 6: 7937.




 中文版
中文版 英文版
英文版