领域前沿·中国
锰离子作为免疫调节剂的发现及应用展望
卫潇茗 王晨光 张睿 蒋争凡*
(北京大学生命科学学院, 细胞分化与增殖教育部重点实验室, 北大–清华生命科学联合中心, 北京 100871)
| 蒋争凡, 北京大学生命科学学院长聘教授、北京大学–清华大学生命科学联合中心高级研究员。1987至1994年在兰州大学生物系先后获得学士及硕士学位, 1997年在北京大学获博士学位, 之后分别赴美国克利夫兰医学中心及Scripps研究所从事博士后研究, 2006年回国进入北京大学任教。2013年获“谈家桢生命科学创新奖”。蒋争凡教授主要从事天然免疫相关研究,围绕天然免疫活化及调控的分子机制及天然免疫的失调与自身免疫病及肿瘤等方面取得了重要进展: 是世界上同期发现STING蛋白的三个实验室之一(命名为ERIS, 也称为MITA); 发现细胞通过STING-TBK1活化STAT6招募免疫细胞; 发现多种Caspase负调控天然免疫反应; 发现锰元素不仅在抗病毒及抗肿瘤的cGAS-STING通路中发挥“警报素”与“激动剂”的双重功能, 还发现锰离子是一个不依赖于dsDNA的cGAS激动剂, 为锰元素作为免疫调节剂的功能研究打开了一个窗口。 |
【摘要】 金属元素是生命体中的重要成分。近年来, 金属免疫学的发展令人瞩目, 其广度和深度正在被快速地拓宽和挖掘。锰元素是金属免疫学研究领域中的后起之秀, 越来越多的研究表明, 锰(离子)在免疫系统中扮演了很重要的角色, 锰离子所具有的免疫调控功能相当丰富, 其作用被大大低估。现有的研究结果提示, 锰离子在营养免疫和天然免疫等过程中发挥功能。该文对于锰金属免疫学进行了详述, 从多个层面介绍并分析了锰离子的免疫调控功能, 提出了锰离子作为细胞危险相关分子模式的工作模型, 并总结和展望了基于锰离子免疫调控功能而发展出的现有的及未来可能的不同应用。
【关键词】 锰离子; 免疫调控; 天然免疫; 抗病毒; cGAS-STING通路; 危险相关分子模式; 佐剂; 肿瘤免疫疗法
【Abstract】 Metals are essential components of all living beings. The progress of metalloimmunology has been remarkable in recent years, in which the breadth and depth are being explored rapidly. Manganese is a promising member in the field of metalloimmunology. Increasing studies indicate that manganese (Mn2+) plays an indispensable role in the immune system with its actual immunomodulatory effects vastly underestimated. Available research results show that manganese (Mn2+) not only functions in nutritional immunity, but also in innate immunity and so on. This review introduces manganese metalloimmunology in detail, analyses Mn2+-dependent immunomodulation in multi-aspects, proposes a working model for Mn2+ acting as a new member of DAMPs (danger associated molecular patterns), and discusses the future immunomodulatory application of Mn2+.
【Keywords】 Mn2+; immune regulation; innate immunity; anti-virus; cGAS-STING pathway; DAMPs (danger-associated molecular patterns); adjuvant; tumor immunotherapy
金属元素是生命体不可或缺的组成部分, 其重要性体现在许多方面: 金属元素在几乎所有的生命过程中发挥了重要作用, 如基因表达调控、细胞信号转导及个体发育等; 约三分之一的已知蛋白酶需要金属离子行使生理学功能, 后者作为辅因子发挥结构、催化或调节的功能[1]; 由于带电荷的金属离子不能自由地跨越磷脂双分子层流动, 金属离子的跨膜浓度梯度易于形成, 因而金属离子具有作为信号传递中间体的天然优势, 其中最广为人知的便是钙离子的第二信使功能。事实上, 如果将第二信使简单定义为通过浓度变化转导信号, 调节细胞内蛋白功能的非蛋白类化学小分子, 那么除了钙之外的很多金属离子都在一定程度上符合这个定义, 例如: 胞内锌离子浓度的上升有助于对磷酸酶SHP-1(SH2-containing protein tyrosine phosphatase-1)活性的抑制和激酶ZAP-70(zeta chain of T cell receptor associated protein kinase 70)活性的增强, 从而协助T细胞受体通路的激活和T细胞成熟[2]; 胞内钾离子浓度的降低有助于激活NLRP3(NLR family pyrin domain containing 3)炎症小体, 并且该现象是在多种结构、性质截然不同的诱导物引起NLRP3激活时普遍存在的[3]; 胞浆中锰离子浓度的升高能够显著增强环GMP-AMP合酶(cyclic GMP-AMP synthase, cGAS)和干扰素基因刺激蛋白(stimulator of interferon gene, STING)的活性, 从而助力于机体抵抗DNA病毒的感染[4]。金属元素在免疫系统中极为重要。近一百年前, 人们就已经发现了金属元素调节免疫系统的案例: 当今在人体唯一被广泛使用的佐剂是于1926年被发现并逐步应用的铝佐剂[5]; 镍接触性皮炎在1950年大规模出现, 直到2010年研究人员才发现镍离子通过结合并激活Toll样受体4(Toll-like receptor4, TLR4), 促使巨噬细胞释放炎性细胞因子并激活T细胞, 引发超敏反应[6]; 顺铂作为化疗药物, 多年来在临床上被广泛应用于多种实体瘤的治疗[7]; 最近发现的钾离子在肿瘤免疫环境中对T细胞代谢的影响[8]及T细胞分泌IFN-γ(interferon gamma)促进肿瘤细胞铁死亡的研究[9], 使得人们对金属离子在肿瘤免疫中的作用有了新的认识, 并提示诱导铁死亡可能作为一种新的肿瘤免疫治疗手段。这些金属离子免疫调控功能的发现极大地促进了金属免疫学的发生与发展, 使得这个重要学科越来越引人注目[10]。锰元素(manganese, Mn)属于过渡金属元素, 是地球上含量第五多的金属元素, 广泛存在于地表和海底。锰的应用很多, 包括有色金属、化工、农业和医药等领域。锰元素大多以二价锰离子(Mn2+)的形式存在, 后者的离子半径处于钙离子和镁离子之间。体外实验显示, 锰离子几乎能与所有的钙离子和镁离子结合位点相结合, 而且在一些需要钙离子或镁离子参与的生物过程中, 锰离子通常能够替代上述两种离子的功能[11-13]。从生物化学的角度来看, 锰离子和镁离子在细胞中的催化作用存在着密切的联系。一方面, 二者具有相似性, 锰离子经常能够替代镁离子作为催化核心与酶结合, 催化类似的生化反应发生; 另一方面, 二者发挥的功能又是不尽相同的, 具体体现在对底物的偏好性和亲和力、反应的产物和酶促反应的效率等方面。在锰离子替代镁离子进行的体外催化反应中, 酶的活性通常会比以镁离子为催化核心时更高。2018年一个令人意外的发现, 不同离子的结合使核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)的活性甚至功能发生显著变化: Rubisco与镁离子结合有利于底物RuBP的羧化; 而当Rubisco与锰离子结合时, 则促进底物的氧化。这样, 锰离子催化的光呼吸原初反应会产生乙醇酸和丙酮酸, 后者促进叶绿体中苹果酸的产生和硝酸盐的同化, 使得光呼吸不再是传统意义上的纯耗能过程[14]。而我们实验室[15]最近的研究则发现, 锰离子催化cGAS产生第二信使cGAMP(cyclic GMP-AMP)的过程与镁离子大不相同, 并且完全不依赖于DNA。作为金属免疫学的重要一员, 近年来锰离子在免疫系统中的功能研究进展迅速。本文总结了锰元素在免疫系统不同环节中发挥的功能, 并对锰离子免疫激活功能的应用潜力进行了评述, 最后对锰离子作为免疫调节剂的实际应用进行了展望。
1 锰的稳态
锰元素是生命体所必需的微量元素之一。成年人体内的锰元素含量约为10~20 mg。锰元素普遍存在于人体中的所有细胞内, 而细胞中主要贮存锰的部位是细胞核、线粒体和高尔基体。锰元素的胞内稳态的维持机制尚不完全知晓。目前已知的参与锰转运的蛋白或系统包括二价金属离子转运蛋白-1(divalent metal transporter 1, DMT1)、锌转运蛋白ZIP8/14、钙池调控的钙离子通道及转铁蛋白系统等[16-20]。大多数已知的锰转运蛋白是非特异性的, 尚不能解释锰离子的胞内浓度是如何选择性地得以维持而不影响其他金属离子的稳态。细胞膜内外以及细胞中不同的亚细胞结构之间存在着不同的锰离子(Mn2+)浓度差。正如上文提到, 这种性质使得锰离子具有了“信使”的潜力。锰元素通过调控一系列的锰离子催化酶来发挥功能, 在许多生命过程中发挥重要的调控功能。这些锰依赖酶包括, 但不限于氧化还原酶、异构酶、连接酶、裂合酶和水解酶, 例如超氧化物歧化酶和谷氨酰胺合成酶等[21]。
通常来说, 食物来源的锰元素足以保障生物体对锰的需求。正常的成年人大约只能够吸收食物中摄入锰的3%~5%, 其进入循环后大部分被肝细胞摄取, 多余的锰则途经胆汁、肠道, 最后通过粪便排出, 反映出机体对锰的吸收有非常严格的调控及锰的稳态对于生物体正常的生理功能是必不可少的。由于食源性锰缺乏症的罕见性, 故通常在实验条件下研究锰稳态失调产生的影响。研究发现, 锰元素缺乏的生物体中出现多种病症, 包括生长障碍、骨骼异常、运动失调和糖脂代谢异常等[22-23]。此外, 只有少数的基因缺陷会导致锰元素的稳态失调。例如, SLC39A14(solute carrier family 39 member 14, 又名ZIP14)或SLC30A10(solute carrier family 30 member 10, 又名ZnT10)的缺陷会引起遗传性的高锰血症, 导致肌张力障碍和神经退行性病变等疾病的发生[19,24]; SLC39A8(solute carrier family 39 member 8, 又名ZIP8)的突变则会导致严重的锰缺乏综合征, 与发育迟缓和青少年特发性脊柱侧弯(adolescent idiopathic scoliosis, AIS)等病症存在关联[25]。锰元素的稳态对于免疫系统功能的影响还需要进行更多的研究。
2 锰元素是营养免疫中的重要环节
铁、锌和锰等金属元素是病原微生物生长和繁殖必需的营养元素。为了抵抗入侵的病原微生物, 机体采取多种方法限制其获取这些营养元素, 这种防御机制被称作营养免疫。锰元素是许多细菌蛋白功能发挥所必需的, 例如, 锰依赖的超氧化物歧化酶(sodA)、ppGpp合酶、PEP羧化酶和PEP羧化激酶等[26]。病原微生物通过表达高亲和力的锰转运体来获得更多的锰元素。细菌中常见的锰转运系统包括MntABC和MntH蛋白家族等[27-28]。这些锰转运蛋白功能的缺陷会减弱许多细菌的毒力, 包括酿脓链球菌(Streptococcus pyogenes)、鼠疫耶尔森氏菌(Yesinia pestis)、流产布鲁氏菌(Brucella abortus)和肺炎链球菌(Streptococcus pneumoniae)等[28-30]。
锰元素是营养免疫中关键的一环, 因此机体采取不同的方式分别从胞外和胞内水平限制感染部位的锰元素含量。S100蛋白家族成员钙卫蛋白(calprotectin)负责调控胞外的锰浓度, 从而限制病原微生物的生长[31]。研究表明, 当葡萄球菌感染发生时, 机体中的脓肿部位几乎检测不到锰元素, 而在健康组织中锰的含量是正常的。钙卫蛋白缺陷的小鼠感染了葡萄球菌后, 其脓肿组织中则富含锰元素, 并且菌的繁殖能力变得更强[32]。Nramp1(natural resistance-associated macrophage protein-1, 又名DMT-2)被用于调节胞内的锰元素水平[33]。NRAMP1在中性粒细胞和巨噬细胞等多种细胞中表达, 能够将锰转运出吞噬体, 限制吞噬体中的病原微生物获取锰。NRAMP1的突变会造成机体对多种胞内病原体的易感性[34]。综上所述, 宿主和病原微生物分别采取策略对于锰元素展开了争夺, 其成败对于感染是否发生是至关重要的。
3 锰离子是天然免疫的传令兵
天然免疫系统是机体抵抗病原体入侵和感染的第一道防线, 能够通过各种不同的模式识别受体(pattern recognition receptors, PRRs)识别不同病原体所共有的病原相关分子模式(pathogen associated molecular patterns, PAMPs), 例如鞭毛蛋白、脂多糖和病毒核酸等。机体中的PRRs主要包括Toll样受体(Toll like receptor, TLR)、RIG-I样解旋酶受体(RIG-I-like helicase, RLH)、NOD样受体(NOD-like receptor, NLR)和cGAS-STING。早在几十年前, 锰离子对于天然免疫的作用就有一些零星报道, 例如人们发现, MnCl2的腹腔注射可能通过介导I型干扰素(type I interferons, I-IFNs)的产生, 从而增强了幼鼠体内自然杀伤细胞的活性[35], 但是其促进I型干扰素产生的机制完全不清楚。近年来更多的研究表明, 锰离子对于一些PRRs的激活也有着重要的影响。我们近期的研究表明, 锰离子能够发挥危险相关分子模式(danger-associated molecular patterns, DAMPs)或警报素(alarmin)的作用, 传递病毒入侵的信号并激活天然免疫系统中的不同环节, 从而协助机体抵抗病毒的入侵, 是一个天然免疫的“传令兵”。
3.1 锰离子和cGAS-STING通路
锰离子作为警报素的第一重功能, 体现在其激活cGAS-STING通路的能力[4]。当病毒入侵机体时, 会破坏宿主细胞的线粒体膜电位并导致细胞器的酸化, 使得线粒体、高尔基体等贮锰细胞器中的锰离子释放到胞质及胞外。细胞质中升高的锰离子浓度对于cGAS-STING通路具有双重的激活作用, 促进大量的I型干扰素产生。一方面, 锰离子作用于cGAS, 能够上万倍地提升cGAS对于双链DNA(double stranded DNA, dsDNA)检测的灵敏性并促进其酶活(即提升合成第二信使cGAMP的能力); 另一方面, 锰离子作用于STING, 增强其与多种环化二核苷酸(cyclic dinucleotides, CDNs)的亲和能力。总的来说, 锰离子能够使得细胞中的cGAS-STING通路处于超活化的状态, 提升其对于细胞质中的dsDNA(细胞质DNA或DNA病毒)的响应灵敏度, 甚至使其在原本不具激活能力的dsDNA水平下也能够被激活[36]。此外, 体外实验表明, 不管被病毒感染的细胞是活着还是发生了焦亡, 其细胞外的锰离子浓度都会升高。同时, 当小鼠受到病毒感染时, 其气管肺泡灌洗液、白细胞及肺泡巨噬细胞中检测到升高的锰离子浓度。值得注意的是, 当小鼠缺乏锰元素时, 其抵抗DNA病毒的能力受到了显著的抑制。这些实验证据提示了锰离子的释放与抗病毒反应的生理学相关性。向细胞外释放的锰离子可能被远端的树突状细胞、巨噬细胞和淋巴细胞摄取, 增强这些免疫细胞中的天然免疫反应, 进而加快适应性免疫的进程。
近期发表的工作及我们正在进行的研究为锰离子激活cGAS-STING通路提供了新的实验证据。研究表明, 锰离子激活cGAS可以独立发生而不依赖于dsDNA的存在[37]。我们最近的研究发现, cGAS催化合成cGAMP的过程在锰离子单独存在时或镁离子和dsDNA共同存在时显著不同。结构生物学的研究表明, 锰离子与cGAS结合的晶体结构中, 锰离子结合于cGAS蛋白, 导致其构象产生很大的变化。cGAS结合锰离子产生的构象变化与结合DNA时的构象变化大体相似, 但催化中心的结构却明显不同, 导致cGAMP在cGAS酶催化中心的合成过程也发生很大变化[15]。这些研究为锰离子作为免疫调节剂的功能研究提供了新的方向。综上, 我们认为锰离子具有的诱导、动员能力及免疫激活活性使其具有了作为危险相关分子模式或警报素的潜力。
3.2 锰离子和NLRP3炎症小体通路
NLRP3炎症小体的激活机制还未达成共识, 原因在于其能够对于多种差异较大的刺激物产生响应, 包括颗粒物(石棉、二氧化硅和尿酸结晶等)、穿孔毒素、ATP和一些病原体等[38]。NLRP3炎症小体的激活能够导致炎性细胞因子IL-1β(interleukin-1 beta)和IL-18(interleukin-18)等的释放和细胞焦亡的发生, 是细胞中重要的模式识别受体通路之一。研究表明, 锰离子能够激活NLRP3炎症小体通路, 在神经细胞中引起自噬小体–溶酶体的损伤和神经炎症的加速[39]。此外, 细胞焦亡发生后炎症受体蛋白ASC(apoptosis-associated speck-like protein containing a CARD)会聚集到细胞外, 含ASC的外泌体随着体液运输, 从而形成了细胞间ASC的传递以及NLRP3炎症小体通路激活的传播[40]。锰离子的处理能够促进LPS预处理的小胶质细胞中ASC外泌体的分泌和在细胞间的传播[41]。当使用LPS和锰离子处理的小胶质细胞产生的ASC外泌体作用于受体细胞时, 相较于未使用锰离子处理的对照组, 细胞中NLRP3和pro-IL-1β的mRNA水平明显升高。处于慢性锰暴露环境的人群(例如电焊工)中, 其血清中ASC外泌体和炎性细胞因子的含量相较于对照组更多。长期处于富锰环境中可能导致这些人群的血浆外泌体中具有更多错误折叠的α-突触核蛋白(α-synuclein), 进而发展出一些神经疾病的症状[42]。锰离子介导的炎症激活和ASC外泌体释放预示着另外一种通过锰离子来警示危险信号的机制。
我们实验室[43]最近研究发现了锰离子激活NLRP3炎症小体通路的更多机制和应用。研究表明, 锰离子激活NLRP3炎症小体不依赖于固体颗粒形成或线粒体DNA泄漏, 而与ROS产生、钾离子外流和钙离子释放存在密切联系。单独的锰离子处理时不会诱导IL-1β和IL-18的切割和释放, 但会诱导GSDMD(Gasdermin D)的切割和细胞焦亡的发生。这些性质具有重要的意义: 锰离子作为DAMP传递危险信号的同时不会引发系统性的炎症反应。对于后文介绍的以锰离子为基础的新型锰佐剂来说, 这也是其毒副作用显著低于其他佐剂的可能原因。
3.3 锰离子和保护性细胞凋亡
细胞凋亡与天然免疫, 特别是抗病毒免疫之间具有密切的联系。病原体的入侵能够激活宿主的天然免疫反应, 包括: (1)抗感染I型干扰素等细胞因子的产生; (2)炎性小体(inflammasome)的活化; (3)细胞凋亡(apoptosis)活化以杀死被感染的细胞。由于病毒的复制依赖于被感染细胞的完整性, 被感染细胞的凋亡能够阻断病毒的复制, 是机体中抑制病毒传播的重要方式。同时, 有研究表明转录因子IRF3介导的抗病毒免疫反应不仅包括诱导IFNs和抗病毒基因的表达, 也包括激活RIPA细胞凋亡通路(the RLR-induced IRF3-mediated pathway of apoptosis), 从而阻止病毒的复制[44]。虽然三者对于清除病原微生物都很重要, 但任何一条通路的过度活化均会引起自身免疫疾病的发生, 所以天然免疫系统的稳态维持非常重要。我们曾发现感染后活化的炎性蛋白酶(inflammatory caspases: CASP1/11/4/5)切割cGAS, 抑制胞质DNA诱导的I型干扰素产生[45]; 而感染导致的细胞凋亡被活化时, 激活的凋亡效应蛋白酶(apoptotic effector caspases: CASP3/6/7)会切割天然免疫通路中的关键蛋白: cGAS、MAVS和IRF3, 并使这些蛋白完全失活, 避免天然免疫过度活化及细胞因子过度产生。更为重要的是, 凋亡蛋白酶切割天然免疫蛋白是细胞凋亡维持“天然免疫沉默”的重要机制。这样的“免疫沉默”对于机体的正常生理活动是至关重要的。否则胚胎无法正常发育, 而成年个体则会始终处于发炎状态[46]。由此可见, 这种保护性的细胞凋亡是天然免疫中的重要环节。
由于锰离子对于细胞凋亡的作用是下文所述锰离子的警报素功能中重要的一环, 下面将对锰离子与细胞凋亡之间的联系进行阐述。在低浓度下, 锰离子具有类似过氧化氢酶的活性, 能够作为抗氧化剂促进氧化应激的消除[47]。但在高浓度下, 锰离子也能够促进细胞凋亡的发生[48], 其作用途径可能依赖于半胱天冬酶caspase-8或caspase-12的激活[49-50]。锰离子对于细胞凋亡的作用可能是与其浓度和作用的细胞类型有关的。值得注意的是, 锰离子能够在多个前列腺癌细胞株中增加G0/G1期滞留的细胞并诱导其凋亡, 具有在前列腺癌治疗中应用的潜力[51]。
锰离子还能从多个层面激活ATM-p53信号通路。首先, ATM(ataxia telangiectasia mutated)的激酶活性依赖于锰离子[52]。其次, 锰离子对于MRN复合物(Mre11/Rad50/Nbs1)十分重要。锰离子对于Mre11的核酸外切酶活性是必需的, 并且不能够被镁离子或钙离子所替代[53]。此外, 锰离子的处理也能够使细胞中的p53水平升高[54]。ATM-p53通路促进细胞凋亡的发生, 而快速有效地清除凋亡细胞是维持机体稳态的重要前提[55]。综上, 病毒感染的细胞中局部高浓度的锰离子也可能会诱发保护性的细胞凋亡, 从而以“建立隔离带”的方式阻止感染的传播。
3.4 锰离子的警报素功能
锰离子是天然免疫活化的使动因素之一。综合前面提到的这些锰离子所具有的多样免疫激活能力, 我们总结并猜想锰离子作为细胞危险相关分子模式在天然免疫中充当传令兵的工作模式图(图1)。锰离子的化学梯度的维持及锰盐的固定是持续耗能的过程, 因而细胞的代谢系统对于锰的正常分布是必要的。当病毒入侵细胞后, 劫持细胞中的代谢系统并引起锰离子的释放, 建立了从感染中心向外逐渐降低的锰离子浓度梯度。感染中心的细胞中具有最高浓度的锰离子, 后者激活caspase并引起细胞凋亡的发生, 建立了阻止感染蔓延的第一道防火带; 邻近感染中心的细胞暴露在次强的锰离子信号中, 这些细胞中发生ATM-p53和NLRP3炎症小体通路的激活, 上调了对于DNA断裂等感染早期分子生物学事件的侦测灵敏度, 促进细胞凋亡和细胞焦亡的发生, 建立了防止感染扩散的又一道防火带; 与感染中心距离更远的细胞中, I-IFNs等多种抗感染细胞因子和趋化因子大量表达, 吸引招募大量的专职免疫细胞如淋巴细胞、巨噬细胞及树突状细胞, 并促进树突状细胞的成熟及抗原递呈, 进而激活获得性免疫; 更远端的细胞中, cGAS-STING通路被预先活化, 显著降低了对于胞内病原体的检测线, 从而使细胞处于一种机警的状态。鉴于病原体发展了多种逃避机体中模式识别受体等主动防御模式的机制, 这种细胞中稳态破坏所活化的被动防御机制就显得尤为重要了。
同时, 锰离子-DAMPs模式符合能量消耗最优化的原则。这种模式的精妙之处在于充分活化各类细胞的同时, 付出的却是细胞中最小的代谢负担。对于不同的细胞, 锰离子所传递的警报和引起的后果是不同的。对于处在危险之中的感染中心或邻近的细胞, 最强烈的锰离子信号直接引起细胞的死亡, 切断病毒的传播, 消耗最多的能量; 对于中等距离的细胞, 中等强度的锰离子信号启动抗感染蛋白的合成, 消耗中等的能量; 对于更远端的细胞, 锰离子信号只是启动了细胞中预先存在的最基本的抵御机制, 提升对于感染的检测灵敏度, 消耗最少的能量。综上, 锰离子能够根据不同的感染风险, 在机体中激活不同的生化过程, 从而在保证足够的防御能力的同时, 消耗最小的能量总和。
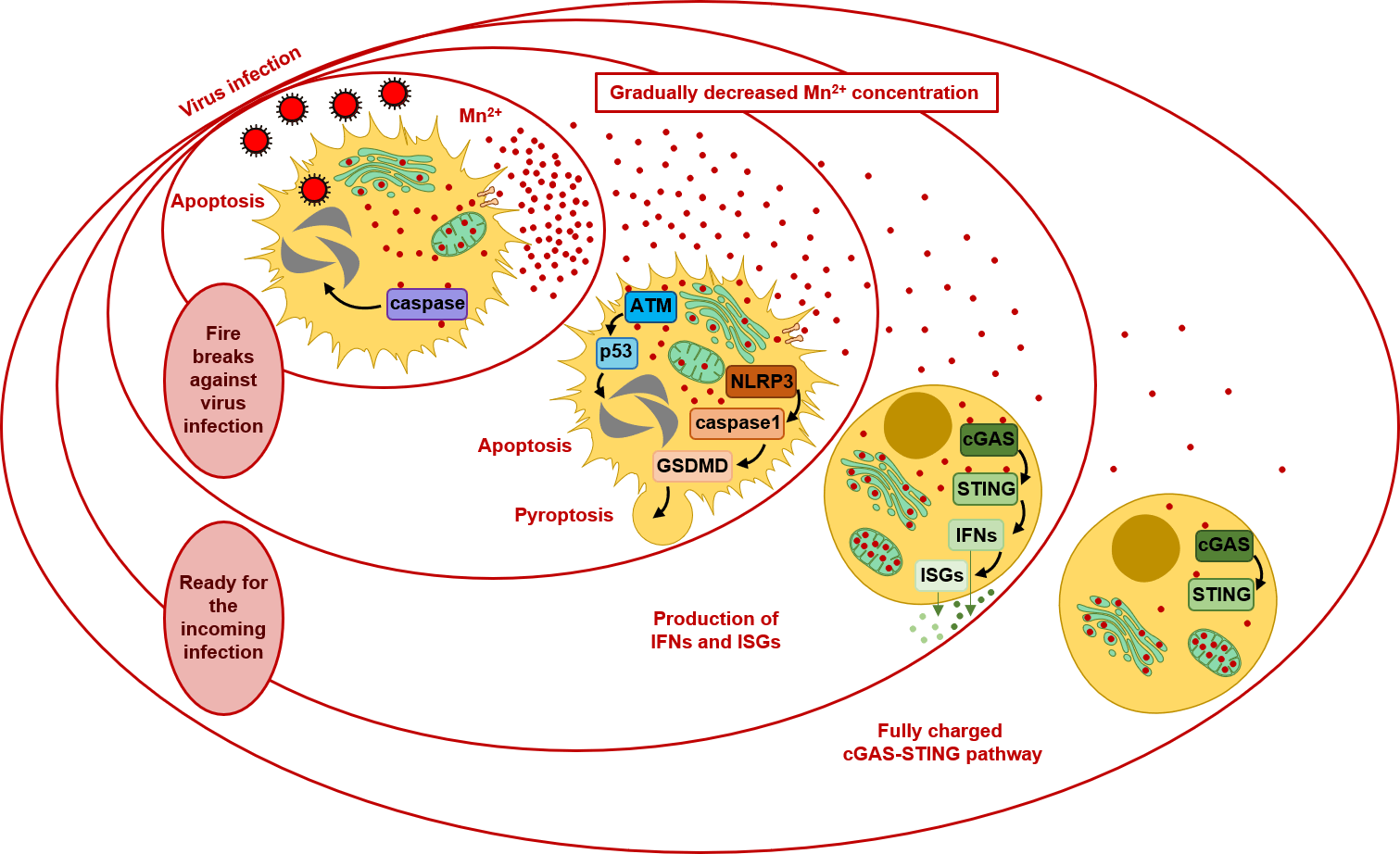
图1 锰离子是天然免疫的传令兵
Fig.1 Mn2+ is a messenger of the innate immunity
4 锰离子免疫激活性质的应用
总的来说, 现阶段基于锰离子免疫激活性质的应用还处于较为初始的阶段。以往对于锰离子的应用很少是基于其免疫激活能力的, 而多是与锰离子本身所具有的一些物化性质相关, 例如基于锰离子具有的核磁共振T1信号而开发的含锰的MRI造影剂锰福地吡。此外, 基于锰离子所具有的核磁共振T1信号及锰化合物在不同pH下的稳定性差异, 研究者设计并合成了以MnO2为外壳, 内部装载了化疗药物和/或光动力学疗法药物的纳米颗粒用于癌症治疗[56-57]。由于肿瘤微环境是偏酸性的, 该纳米颗粒到达肿瘤微环境后, MnO2外壳发生崩解并导致锰离子和药物的释放, 从而实现对于肿瘤的核磁共振成像和药物的靶向释放。在逐渐的应用过程中, 也有研究者开始聚焦于锰离子激活免疫的能力。最近, 有研究者制备了基于锰纳米颗粒的肿瘤治疗药物, 通过在肿瘤处释放锰离子和经典抗癌药物DOX, 在小鼠肿瘤模型中展现出了较好的治疗效果[58]。另外, 也有研究者设计了装载光敏剂的MnO2纳米颗粒用于治疗皮肤脓肿。得益于锰离子免疫激活的性质, 当进行光动力学治疗后, 锰离子和释放的细菌抗原强烈地激活了免疫系统, 使得小鼠获得了病原特异性的免疫记忆, 从而能够更好地抵御病原体的再次入侵[59]。综上, 锰离子的应用前景是值得期待的。下面将对锰离子佐剂和锰离子与免疫检查点抑制剂在肿瘤治疗中的联合应用这两个方向进行详述。
4.1 锰离子佐剂
免疫佐剂被广泛应用于肽段或重组蛋白等类型的疫苗中, 能够增强抗原的免疫原性、针对抗原的免疫应答、抗体的产生和免疫记忆的时程等。良好的佐剂在具备安全性的前提下能够很好地提升疫苗对于机体的免疫保护效果。抗原与佐剂的不同搭配可能产生不同的效果, 因而在选择疫苗的佐剂时, 需要考虑到抗原的物化性质、所诱导免疫反应的类型以及疫苗接种人群和方式等因素。铝佐剂是以氢氧化铝和磷酸铝为主的无机铝盐佐剂的统称。至今为止, 铝佐剂是唯一一种广泛应用于人用疫苗的佐剂[60]。尽管如此, 铝佐剂所具有的一些问题也引发了人们的关注。一方面, 从疫苗的效果方面来看, 铝佐剂的效率较低。铝佐剂只能激活体液免疫反应诱导抗体的产生, 不能激活细胞免疫反应活化细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTLs)[61]。这个性质限制了铝佐剂的应用, 使其不能作为抗病毒及抗肿瘤疫苗的佐剂。另一方面, 从疫苗的使用成本和安全性来看, 在低温环境中铝佐剂的胶体性质会遭到破坏, 反复的冻融会显著降低铝佐剂疫苗的有效性, 其运输和储存的成本较高[62]。铝佐剂相对不稳定性也影响着疫苗的安全性, 可能降低疫苗的效价并损害有效的免疫保护的形成。正因如此, 一些其他佐剂的研发正在积极的临床试验之中。新型的佐剂被人们寄予了更多的期望, 例如: 减少抗原的使用量, 在传染病全球性爆发时让更多的人及时接种, 减缓疾病的进程; 诱导更迅速的免疫反应, 提升暴露于抗原后接种的效果; 对更多亚型的病毒具有免疫保护作用, 提升对于流感在内的高突变率病毒的交叉防护效果; 用于治疗型疫苗中, 例如肿瘤个性化疫苗等。
通常来说, 天然免疫的激动剂具有成为免疫佐剂的潜力。鉴于锰离子是天然免疫的激动剂, 能够诱导细胞产生大量I-IFNs等细胞因子, 我们研制了一种含有稳定胶体性状的纳米锰合物佐剂(MnJ)[43]。进一步的研究表明, MnJ能够在包括蛋白肽段、重组蛋白和灭活病毒在内的疫苗类型中充当佐剂。MnJ普适性的基础在于其多样的免疫激活能力: 最为核心的一点是, MnJ能够强效地激活体液免疫以及细胞免疫反应, 诱导高浓度抗体产生的同时激活T细胞(特别是CTLs), 弥补了铝佐剂不能作为抗病毒和抗肿瘤疫苗佐剂的缺陷; MnJ也能激活黏膜免疫反应并诱导大量分泌型IgA的产生, 因而也用作黏膜免疫的佐剂; 还能够强烈促进树突状细胞(dendritic cell, DC)的成熟, 使得机体对抗原性弱的抗原也能产生抗体。此外, MnJ无毒副作用, 不会诱导系统性的炎症反应, 具有生物安全性。综合考察上述MnJ的性质(图2), 我们认为, MnJ作为免疫佐剂的潜力是巨大的, 会在不久的将来从多个方面造福于人类。
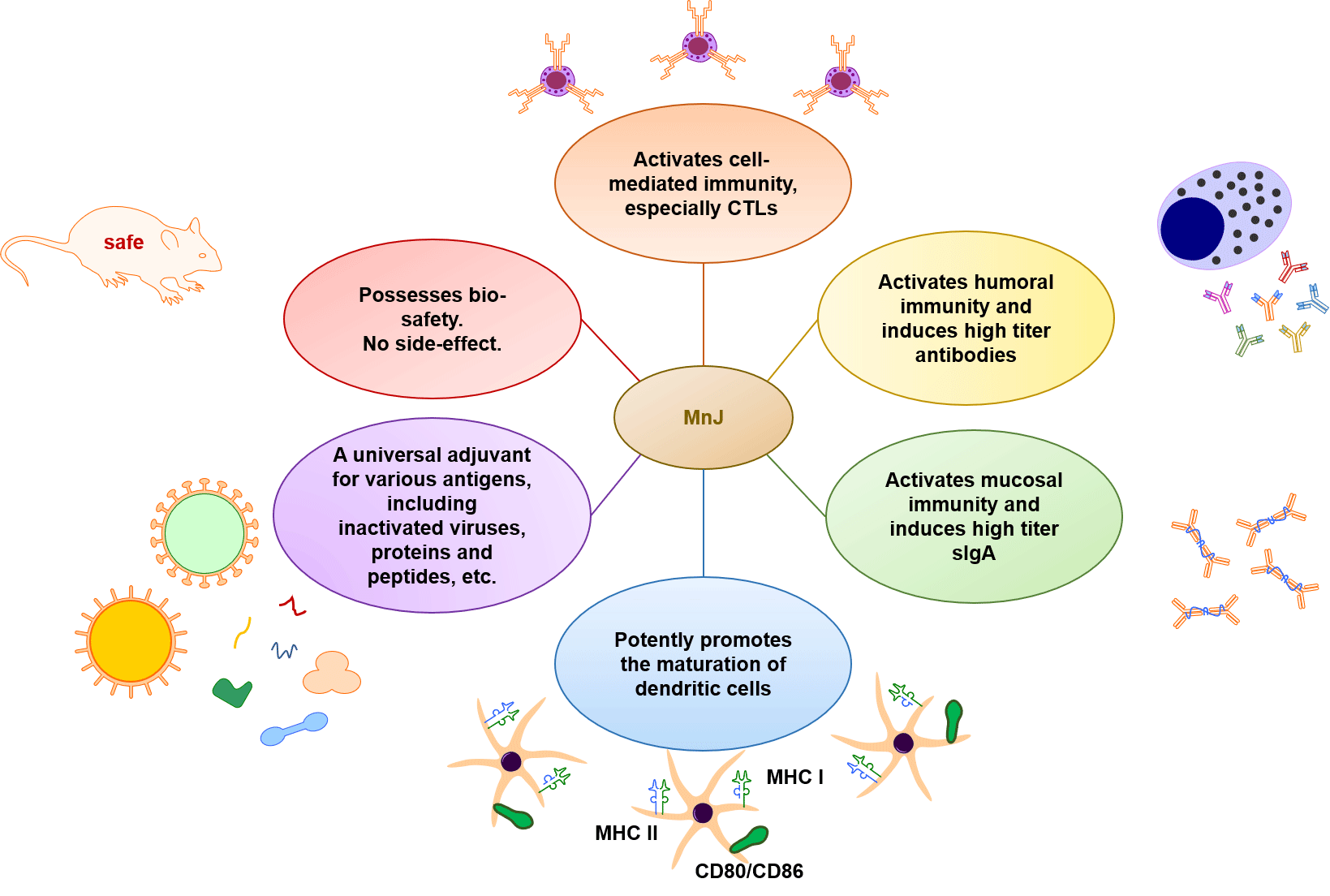
图2 纳米锰合物佐剂(MnJ)的特性
Fig.2 Properties of MnJ adjuvant
4.2 锰离子与免疫检查点抑制剂联合用于肿瘤治疗(锰免治疗)
在肿瘤的发展过程中, 体内的免疫细胞通常处于被抑制的状态。肿瘤的免疫检查点抑制剂疗法相当于将免疫细胞的刹车(CTLA-4和PD-1等)松开, 使T细胞恢复应有的对癌细胞的杀灭作用。作为国际公认的最有潜力治愈癌症的方法, 肿瘤免疫检查点抑制剂疗法获得了2018年诺贝尔生理学或医学奖。随着近年来的推进, 研究发现这种疗法也存在很大的缺陷, 只能对少数特定类型的肿瘤起到较好的治疗效果(小于20%)。这可能与肿瘤微环境存在着关联。在免疫原性较高的“热肿瘤”中, 免疫检查点抑制剂将肿瘤细胞旁边聚集的大量免疫细胞重新激活, 因而能够显著地发挥疗效; 而对于免疫原性低的“冷肿瘤”, 因为肿瘤微环境中本身就没有或只有较少的免疫细胞, 免疫检查点抑制剂能够发挥的效果十分有限。针对这个缺陷, 许多研究者尝试了不同治疗方法的联用, 例如免疫检查点抑制剂与放疗或病毒联用等[63-64], 在一定程度上提升了对于癌症的治疗效果。同时, 研究表明, cGAS-STING通路参与了机体对于肿瘤细胞的免疫监视过程。肿瘤细胞的DNA激活其旁树突状细胞等抗原递呈细胞, 后者产生大量I-IFNs并将肿瘤抗原呈递给T细胞, 进一步激活了CTLs后实现对肿瘤细胞的杀伤作用。cGAS-STING通路激活剂与免疫检查点抑制剂的联用必将带来更好的治疗效果。因而, 近年来世界各大制药公司的重要目标之一便是寻找cGAS-STING通路的激活剂, 纷纷投入巨资研发[65]。
锰离子是cGAS-STING通路强效的激活剂, 可以被多种细胞通过主动运输进入细胞进行累积。因此, 我们研究了锰离子在抗肿瘤免疫中的潜力。研究发现, 缺锰小鼠对于肿瘤的抵抗能力显著减弱, 说明锰元素在对肿瘤的免疫监视中发挥了重要的作用。同时, 锰离子能够促进树突状细胞的成熟, 进而促进了肿瘤抗原的递呈和CTLs的分化和激活。将锰离子与免疫检查点抑制剂或化疗药物组合使用时, 在多种肿瘤模型中都展现出更好的治疗效果。与锰离子的协同使用还可以减少抗PD-1抗体等昂贵药物的使用量, 而锰离子本身的使用成本极低, 所以锰免治疗可以显著降低肿瘤的医治成本, 造福于个人和国家[66]。综上所述, 我们认为锰离子在肿瘤治疗的作用相当于“踩油门”(图3)。单纯的“松刹车”起到的作用是比较有限的, 若是同时通过“踩油门”, 促进天然免疫系统对肿瘤细胞进行免疫监视, 或者将冷肿瘤转变为热肿瘤, 则可以显著提升肿瘤患者对于治疗的响应率。
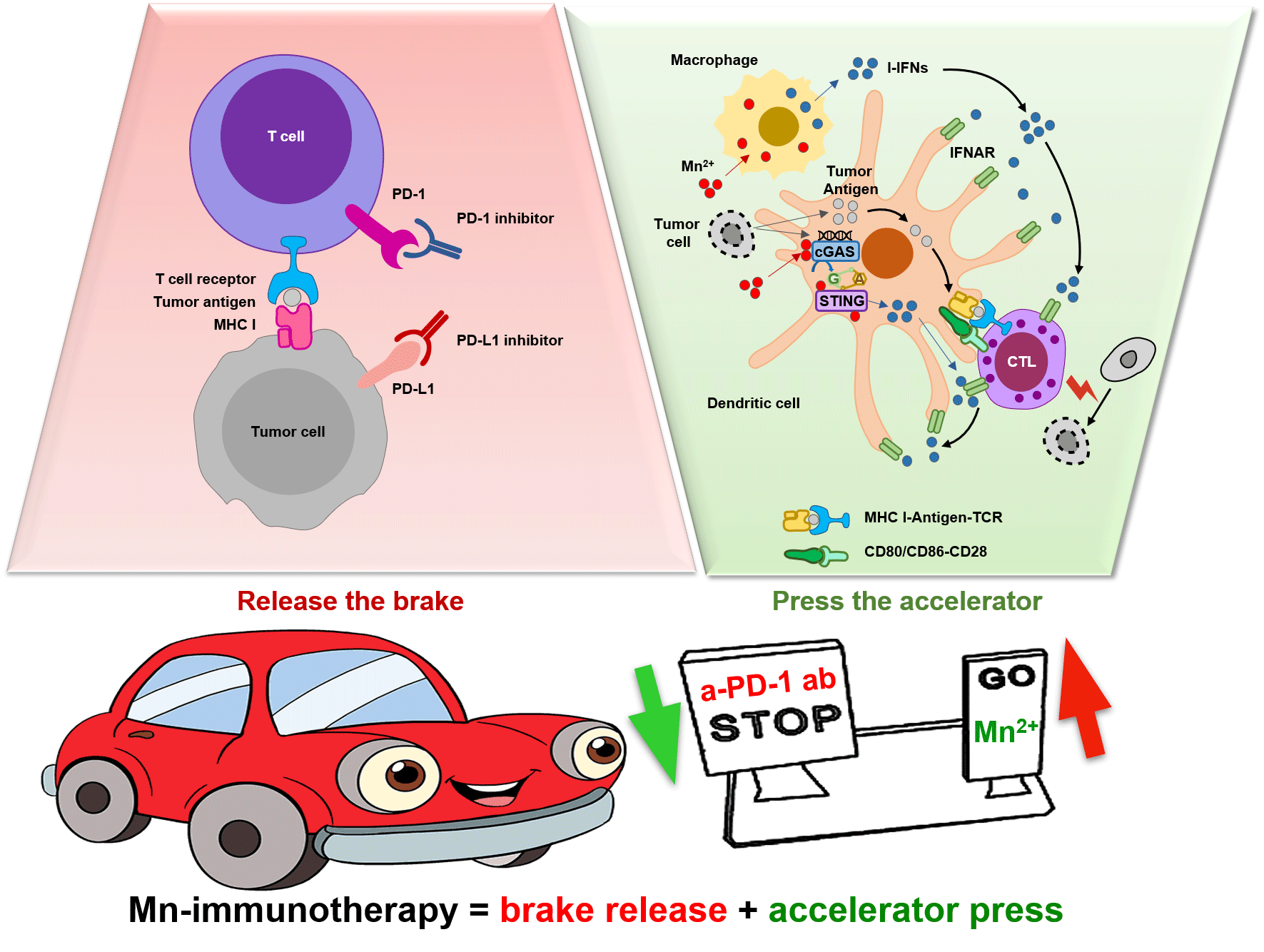
图3 锰免治疗具有“松刹车”+“踩油门”的双重效果
Fig.3 Mn2+ + checkpoint inhibitor therapy has dual effects (brake release and accelerator press)
5 展望
最近几年关于锰离子作为免疫调节剂的功能研究已经有了相当的积累, 有可能随着其天然免疫活化功能的发现而进入“井喷期”。尽管如此, 对于锰的研究还需要技术方法的进步来获得更长足的进展。由于锰离子和钙离子存在着相当程度的相似性, 现有的钙离子荧光探针和抑制剂很难区分开钙离子和锰离子, 这就使得针对锰离子的功能研究难以进行。利用化学与生物学的交叉, 发展锰离子特异性荧光探针或设计锰离子特异的抑制剂等方法必将助力于对锰离子的研究。同时, 现在已有的锰稳态失调动物模型在锰的功能研究中发挥了重要的作用。更多锰转运蛋白的发现及对应动物模型的构建能够从组织、器官和个体水平更全面地评价锰元素对于免疫的影响。另外, 就现有的关于锰离子在免疫系统中的应用来说, 大多数都还处于理论研究阶段, 要真正应用于临床还需要攻克很多难关。与此同时, 在与之相关的领域中我国还存在一些“卡脖子”的技术: 现阶段高效稳定的铝佐剂和白油佐剂等几乎完全依赖于进口; 治疗癌症的免疫检查点抑制剂单抗药物临床需求很大, 而且相当一部分还依赖于进口。锰离子佐剂和锰免治疗的发展将在一定程度上协助突破这些困境。因此, 我们认为基于锰离子的药物具有很大的临床应用潜力, 其重要价值一定会在未来展现出来。
综上所述, 我们相信锰金属免疫学具有重要的理论及实践价值。目前对于锰的认知是相当不全面的, 现在已知的锰元素的免疫调控功能可能只是冰山一角。锰元素还具有许多被远远低估的价值。相信在多学科交叉运用的帮助下, 锰元素作为免疫调节剂的功能将会逐渐变得清晰而丰富, 进而运用于临床惠及国计民生。
参考文献 (References)
[1] TAINER J A, ROBERTS V A, GETZOFF E D. Metal-binding sites in proteins [J]. Curr Opin Biotechnol, 1991, 2(4): 582-91.
[2] KALTENBERG J, PLUM L M, OBER-BLOBAUM J L, et al. Zinc signals promote IL-2-dependent proliferation of T cells [J]. Eur J Immunol, 2010, 40(5): 1496-503.
[3] MUNOZ-PLANILLO R, KUFFA P, MARTINEZ-COLON G, et al. K(+) efflux is the common trigger of NLRP3 inflammasome activation by bacterial toxins and particulate matter [J]. Immunity, 2013, 38(6): 1142-53.
[4] WANG C, GUAN Y, LV M, et al. Manganese increases the sensitivity of the cGAS-STING pathway for double-stranded DNA and is required for the host defense against DNA viruses [J]. Immunity, 2018, 48(4): 675-87.e7.
[5] GLENNY A T, POPE C G, WADDINGTON H, et al. Immunological notes. Note XXIII. The antigenic value of toxoid precipitated by potassium alum [J]. J Pathol, 1926, 29(1): 31–40.
[6] SCHMIDT M, RAGHAVAN B, MULLER V, et al. Crucial role for human Toll-like receptor 4 in the development of contact allergy to nickel [J]. Nat Immunol, 2010, 11(9): 814-9.
[7] COHEN S M, LIPPARD S J. Cisplatin: from DNA damage to cancer chemotherapy [J]. Prog Nucleic Acid Res Mol Biol, 2001, 67(67): 93-130.
[8] VODNALA S K, EIL R, KISHTON R J, et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism [J]. Science, 2019, 363(6434): eaau0135.
[9] WANG W, GREEN M, CHOI J E, et al. CD8(+) T cells regulate tumour ferroptosis during cancer immunotherapy [J]. Nature, 2019, 569(7755): 270-4.
[10] LI J, ZHENG P, ZHAO J, et al. Metal-mediated immune regulations and interventions: prospects of the emerging field of metalloimmunology [J]. Sci Sin Chim, 2019, 49(8): 1037-46.
[11] PORANEN M M, SALGADO P S, KOIVUNEN M R, et al. Structural explanation for the role of Mn2+ in the activity of phi6 RNA-dependent RNA polymerase [J]. Nucleic Acids Res, 2008, 36(20): 6633-44.
[12] WEDLER F C. Biological significance of manganese in mammalian systems [J]. Prog Med Chem, 1993, 30: 89-133.
[13] WENTE S R, VILLALBA M, SCHRAMM V L, et al. Mn2(+)-binding properties of a recombinant protein-tyrosine kinase derived from the human insulin receptor [J]. Proc Natl Acad Sci USA, 1990, 87(7): 2805-9.
[14] BLOOM A J, LANCASTER K M. Manganese binding to Rubisco could drive a photorespiratory pathway that increases the energy efficiency of photosynthesis [J]. Nat Plants, 2018, 4(7): 414-22.
[15] ZHAO Z, MA Z, WANG B, et al. Mn(2+) Directly activates cGAS and structural analysis suggests Mn(2+) induces a noncanonical catalytic synthesis of 2’3’-cGAMP [J]. Cell Rep, 2020, 32(7): 108053.
[16] AU C, BENEDETTO A, ASCHNER M. Manganese transport in eukaryotes: the role of DMT1 [J]. Neurotoxicology, 2008, 29(4): 569-76.
[17] GUNTER T E, GERSTNER B, GUNTER K K, et al. Manganese transport via the transferrin mechanism [J]. Neurotoxicology, 2013, 34:118-27.
[18] PARK J H, HOGREBE M, GRUNEBERG M, et al. SLC39A8 Deficiency: a disorder of manganese transport and glycosylation [J]. Am J Hum Genet, 2015, 97(6): 894-903.
[19] TUSCHL K, MEYER E, VALDIVIA L E, et al. Mutations in SLC39A14 disrupt manganese homeostasis and cause childhood-onset parkinsonism-dystonia [J]. Nat Commun, 2016, 7: 11601.
[20] CROSSGROVE J S, YOKEL R A. Manganese distribution across the blood-brain barrier. IV. Evidence for brain influx through store-operated calcium channels [J]. Neurotoxicology, 2005, 26(3): 297-307.
[21] WALDRON K J, RUTHERFORD J C, FORD D, et al. Metalloproteins and metal sensing [J]. Nature, 2009, 460(7257): 823-30.
[22] RODRIGUEZ-RODRIGUEZ E, BERMEJO L M, LOPEZ-SOBALER A M, et al. [An inadequate intake of manganese may favour insulin resistance in girls] [J]. Nutr Hosp, 2011, 26(5): 965-70.
[23] KEEN C L, ENSUNSA J L, WATSON M H, et al. Nutritional aspects of manganese from experimental studies [J]. Neurotoxicology, 1999, 20(2-3): 213-23.
[24] HUTCHENS S, LIU C, JURSA T, et al. Deficiency in the manganese efflux transporter SLC30A10 induces severe hypothyroidism in mice [J]. J Biol Chem, 2017, 292(23): 9760-73.
[25] HALLER G, MCCALL K, JENKITKASEMWONG S, et al. A missense variant in SLC39A8 is associated with severe idiopathic scoliosis [J]. Nat Commun, 2018, 9(1): 4171.
[26] PAPP-WALLACE K M, MAGUIRE M E. Manganese transport and the role of manganese in virulence [J]. Annu Rev Microbiol, 2006, 60:187-209.
[27] KEHL-FIE T E, ZHANG Y, MOORE J L, et al. MntABC and MntH contribute to systemic Staphylococcus aureus infection by competing with calprotectin for nutrient manganese [J]. Infect Immun, 2013, 81(9): 3395-405.
[28] ANDERSON E S, PAULLEY J T, GAINES J M, et al. The manganese transporter MntH is a critical virulence determinant for Brucella abortus 2308 in experimentally infected mice [J]. Infect Immun, 2009, 77(8): 3466-74.
[29] BEARDEN S W, PERRY R D. The Yfe system of Yersinia pestis transports iron and manganese and is required for full virulence of plague [J]. Mol Microbiol, 1999, 32(2): 403-14.
[30] DINTILHAC A, ALLOING G, GRANADEL C, et al. Competence and virulence of Streptococcus pneumoniae: Adc and PsaA mutants exhibit a requirement for Zn and Mn resulting from inactivation of putative ABC metal permeases [J]. Mol Microbiol, 1997, 25(4): 727-39.
[31] DAMO S M, KEHL-FIE T E, SUGITANI N, et al. Molecular basis for manganese sequestration by calprotectin and roles in the innate immune response to invading bacterial pathogens [J]. Proc Natl Acad Sci USA, 2013, 110(10): 3841-6.
[32] CORBIN B D, SEELEY E H, RAAB A, et al. Metal chelation and inhibition of bacterial growth in tissue abscesses [J]. Science, 2008, 319(5865): 962-5.
[33] JABADO N, JANKOWSKI A, DOUGAPARSAD S, et al. Natural resistance to intracellular infections: natural resistance-associated macrophage protein 1 (Nramp1) functions as a pH-dependent manganese transporter at the phagosomal membrane [J]. J Exp Med, 2000, 192(9): 1237-48.
[34] BLACKWELL J M, GOSWAMI T, EVANS C A, et al. SLC11A1 (formerly NRAMP1) and disease resistance [J]. Cell Microbiol, 2001, 3(12): 773-84.
[35] SMIALOWICZ R J, RIDDLE M M, ROGERS R R, et al. Enhancement of natural killer cell activity and interferon production by manganese in young mice [J]. Immunopharmacol Immunotoxicol, 1988, 10(1): 93-107.
[36] MACKENZIE K J, CARROLL P, MARTIN C A, et al. cGAS surveillance of micronuclei links genome instability to innate immunity [J]. Nature, 2017, 548(7668): 461-5.
[37] HOOY R M, MASSACCESI G, ROUSSEAU K E, et al. Allosteric coupling between Mn2+ and dsDNA controls the catalytic efficiency and fidelity of cGAS [J]. Nucleic Acids Res, 2020, 48(8): 4435-47.
[38] LATZ E, XIAO T S, STUTZ A. Activation and regulation of the inflammasomes [J]. Nat Rev Immunol, 2013, 13(6): 397-411.
[39] WANG D, ZHANG J, JIANG W, et al. The role of NLRP3-CASP1 in inflammasome-mediated neuroinflammation and autophagy dysfunction in manganese-induced, hippocampal-dependent impairment of learning and memory ability [J]. Autophagy, 2017, 13(5): 914-27.
[40] FRANKLIN B S, BOSSALLER L, DE NARDO D, et al. The adaptor ASC has extracellular and ‘prionoid’ activities that propagate inflammation [J]. Nat Immunol, 2014, 15(8): 727-37.
[41] SARKAR S, ROKAD D, MALOVIC E, et al. Manganese activates NLRP3 inflammasome signaling and propagates exosomal release of ASC in microglial cells [J]. Sci Signal, 2019, 12(563): eaat9900.
[42] HARISCHANDRA D S, ROKAD D, NEAL M L, et al. Manganese promotes the aggregation and prion-like cell-to-cell exosomal transmission of alpha-synuclein [J]. Sci Signal, 2019, 12(572): eaau4543.
[43] ZHANG R, WANG C, GUAN Y, et al. The manganese salt (MnJ) functions as a potent universal adjuvant [J]. bioRxiv, 2019, 783910.
[44] CHATTOPADHYAY S, SEN G C. RIG-I-like receptor-induced IRF3 mediated pathway of apoptosis (RIPA): a new antiviral pathway [J]. Protein Cell, 2017, 8(3): 165-8.
[45] WANG Y, NING X, GAO P, et al. Inflammasome activation triggers caspase-1-mediated cleavage of cGAS to regulate responses to DNA virus infection [J]. Immunity, 2017, 46(3): 393-404.
[46] NING X, WANG Y, JING M, et al. Apoptotic caspases suppress type I interferon production via the cleavage of cGAS, MAVS, and IRF3 [J]. Mol Cell, 2019, 74(1): 19-31e7.
[47] ARCHIBALD F S, FRIDOVICH I. The scavenging of superoxide radical by manganous complexes: in vitro [J]. Arch Biochem Biophys, 1982, 214(2): 452-63.
[48] SCHRANTZ N, BLANCHARD D A, MITENNE F, et al. Manganese induces apoptosis of human B cells: caspase-dependent cell death blocked by bcl-2 [J]. Cell Death Differ, 1999, 6(5): 445-53.
[49] EL MCHICHI B, HADJI A, VAZQUEZ A, et al. p38 MAPK and MSK1 mediate caspase-8 activation in manganese-induced mitochondria-dependent cell death [J]. Cell Death Differ, 2007, 14(10): 1826-36.
[50] OUBRAHIM H, CHOCK P B, STADTMAN E R. Manganese(II) induces apoptotic cell death in NIH3T3 cells via a caspase-12-dependent pathway [J]. J Biol Chem, 2002, 277(23): 20135-8.
[51] HERNROTH B, HOLM I, GONDIKAS A, et al. Manganese inhibits viability of prostate cancer cells [J]. Anticancer Res, 2018, 38(1): 137-45.
[52] CHAN D W, SON S C, BLOCK W, et al. Purification and characterization of ATM from human placenta. A manganese-dependent, wortmannin-sensitive serine/threonine protein kinase [J]. J Biol Chem, 2000, 275(11): 7803-10.
[53] PAULL T T, GELLERT M. The 3’ to 5’ exonuclease activity of Mre 11 facilitates repair of DNA double-strand breaks [J]. Mol Cell, 1998, 1(7): 969-79.
[54] GUILARTE T R, BURTON N C, VERINA T, et al. Increased APLP1 expression and neurodegeneration in the frontal cortex of manganese-exposed non-human primates [J]. J Neurochem, 2008, 105(5): 1948-59.
[55] YOON K W, BYUN S, KWON E, et al. Control of signaling-mediated clearance of apoptotic cells by the tumor suppressor p53 [J]. Science, 2015, 349(6247): 1261669.
[56] YANG G, XU L, CHAO Y, et al. Hollow MnO2 as a tumor-microenvironment-responsive biodegradable nano-platform for combination therapy favoring antitumor immune responses [J]. Nat Commun, 2017, 8(1): 902.
[57] LIANG R, LIU L, HE H, et al. Oxygen-boosted immunogenic photodynamic therapy with gold nanocages@manganese dioxide to inhibit tumor growth and metastases [J]. Biomaterials, 2018, 177: 149-60.
[58] HOU L, TIAN C, YAN Y, et al. Manganese-based nanoactivator optimizes cancer immunotherapy via enhancing innate immunity [J]. ACS Nano, 2020, 14(4): 3927-40.
[59] WANG C, XIAO Y, ZHU W, et al. Photosensitizer-modified MnO2 nanoparticles to enhance photodynamic treatment of abscesses and boost immune protection for treated mice [J]. Small, 2020, doi: 10.1002/smll.202000589.
[60] HOGENESCH H. Mechanism of immunopotentiation and safety of aluminum adjuvants [J]. Front Immunol, 2012, 3: 406.
[61] MARRACK P, MCKEE A S, MUNKS M W. Towards an understanding of the adjuvant action of aluminium [J]. Nat Rev Immunol, 2009, 9(4): 287-93.
[62] CLAPP T, MUNKS M W, TRIVEDI R, et al. Freeze-thaw stress of Alhydrogel (R) alone is sufficient to reduce the immunogenicity of a recombinant hepatitis B vaccine containing native antigen [J]. Vaccine, 2014, 32(30): 3765-71.
[63] RIBAS A, DUMMER R, PUZANOV I, et al. Oncolytic virotherapy promotes intratumoral T cell infiltration and improves anti-PD-1 immunotherapy [J]. Cell, 2017, 170(6): 1109-19e10.
[64] VAN LIMBERGEN E J, DE RUYSSCHER D K, OLIVO PIMENTEL V, et al. Combining radiotherapy with immunotherapy: the past, the present and the future [J]. Br J Radiol, 2017, 90(1076): 20170157.
[65] FLOOD B A, HIGGS E F, LI S, et al. STING pathway agonism as a cancer therapeutic [J]. Immunol Rev, 2019, 290(1): 24-38.
[66] LÜ M, CHEN M, ZHANG R, et al. Manganese is critical for antitumor immune responses via cGAS-STING and improves the efficacy of clinical immunotherapy [J]. Cell Res, 2020.




 中文版
中文版 英文版
英文版