领域前沿·中国
高精度时空转录组揭示小鼠早期胚胎三胚层细胞谱系发生过程
崔桂忠1 彭广敦2,3 景乃禾1*
(1中国科学院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所细胞生物学国家重点实验室, 上海 200031; 2中国科学院广州生物医药与健康研究院/广州再生医学与健康广东省实验室, 广州 510530; 3中国科学院广州生物医药与健康研究院细胞谱系和图谱中心, 广州 510530)
 | 景乃禾, 中国科学院上海生物化学与细胞生物学研究所研究员, 研究组长。1982年毕业于南京大学化学系, 1988年在中科院上海生物化学研究所获博士学位, 1989年赴日本理化学研究所从事博士后研究。1991年回国任中科院上海生化所研究组长、副研究员, 1995年晋升为研究员、博士生导师。曾任生物化学与细胞生物学研究所常务副所长、细胞生物学国家重点实验室副主任、中国生物化学与分子生物学学会副理事长兼秘书长。还担任Journal of Biological Chemistry (2009—2014年)、Cell Research、IUBMB Life (2010—2013年)、Mechanism of Development、Acta Biochimica Biophysica Sinica、Neuroscience Bulletin编委, BMC Developmental Biology和J Mol Cell Biol副主编等。 |
【摘要】 从受精卵发育成具有不同细胞类型个体的过程中, 细胞命运受到多个层次的调控。 在哺乳动物的早期胚胎发育过程中, 原肠运动是外、中、内三个胚层的建立过程, 为后续的器官发 生和形态建成提供了发育蓝图。然而目前对于三胚层命运建立的分子机制认识并不清晰。该文通 过对小鼠早期胚胎的时空转录组分析, 从分子层面揭示了外、中、内三胚层谱系发生的整个过程。
【关键词】 细胞谱系; 原肠运动; 时空转录组
【Abstract】 Cell fate specification in the development of zygote into embryo proper is regulated at multiple levels. During the early embryonic development of mammals, formation of the three primary germ layers, ectoderm, mesoderm, and endoderm, as the results of gastrulation, provides a blueprint for morphogenesis and organogenesis. However, a comprehensive genome-wide molecular annotation of the mechanisms that determine the tissue architecture and lineage specification of the three germ layers has not been clarified. We show that the entire process of the specification of the ectoderm, mesoderm and endoderm lineages is revealed by analyzing the spatiotemporal transcriptomes of mouse early embryos.
【Keywords】 cell lineage; gastrulation; spatiotemporal transcriptome
生命起始于单个细胞的受精卵, 经过胚胎发 育形成包含多种细胞类型、多个组织器官的个体。 人们利用秀丽隐杆线虫(Nematode Caenorhabditis elegans)研究了细胞谱系和细胞命运决定[1]; 利用 果蝇(Drosophila)第一次鉴定了基因组上的编码区 (coding sequence), 并进一步发现了基因簇[2]。哺乳 动物的胚胎发育更为复杂, 小鼠是人们常用的模式 生物, 其早期胚层分化与细胞谱系建立的过程对认 识高等动物细胞命运的决定具有重要意义。
1 小鼠早期胚胎发育过程
小鼠早期胚胎发育和模式建成是一个复杂而 有序的生物学过程。在小鼠早期胚胎发生过程中, 基因表达的时空调控影响细胞谱系分化、胚胎极 性、细胞和组织的形态运动、组织发育蓝图的建立 等多个过程[3]。受精后, 经合子卵裂形成桑椹胚。随 后, 在胚胎时期3.5天(E3.5), 胚胎经历第一次命运决 定, 形成外部的滋养层细胞(trophectoderm, TE)和内 细胞团(inner cell mass, ICM)[4-5]、囊胚(blastocyst)形 成。当胚胎发育到E4.5时, 囊胚由输卵管进入子宫 发生着床, 细胞发生第二次命运决定, 内细胞团分别 分化为原始内胚层(primitive endoderm, PrE)和上胚 层(epiblast, Epi)。原始内胚层将发育成内脏内胚层 (visceral endoderm, VE)和脏壁内胚层(parietal endoderm, PE)[3](图1)[6]。
在胚胎发育到E5.5时, 没有极性的上胚层细胞 排列为整齐的单层柱状上皮, 即晚期上胚层(late epiblast), 并形成卵筒状的结构(egg cylinder)。在胚胎底 端(distal tip), 内脏内胚层细胞发生命运特化, 其细胞 形态结构与其他位置的内脏内胚层细胞不同, 被称 为远端内脏内胚层(distal visceral endoderm, DVE)。 随后DVE向胚胎一侧移动, 该侧将来发育成为胚胎 的前端(anterior), 这群内脏内胚层细胞被称为前端 内脏内胚层(anterior visceral endoderm, AVE)[7](图1)。AVE是胚胎模式建成的重要信号来源, 可以拮抗后 端Wnt和Nodal信号, 对胚胎前后轴(anterior-posterior axis, A-P)的形成至关重要[3]。
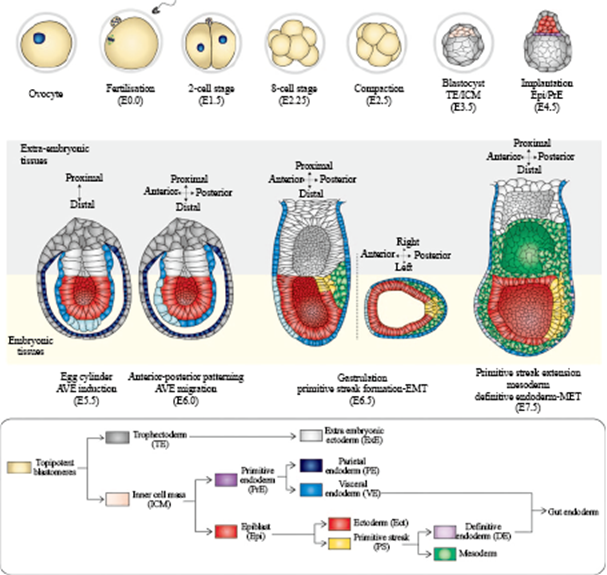
受精卵经过卵裂, 进行第一次命运决定, 形成滋养外胚层(trophectoderm, TE, 灰色)和内细胞团(inner cell mass, ICM, 米色)。在E4.5时, 胚胎着床,内细胞团分化成原始内胚层(primitive endoderm, PrE, 紫色)和上胚层(epiblast, Epi,红色)。在E5.5时, 胚胎成卵桶状, PrE细胞进一步分化成脏壁内胚层(parietal endoderm, PE, 深蓝色)和内脏内胚层(visceral endoderm, VE, 蓝色)。在E5.5~E6.0时, 底端的内脏内胚层向胚胎一侧移动, 移动到胚胎和胚外交界的位置, 形成AVE, 进而建立前后轴。在E6.5时, 原肠运动起始于胚胎后端的原条(primitive streak, PS, 黄色), 发生上皮‒间充质转换(epithelial-mesenchymal transition, EMT)。新生中胚层从后端向胚胎前端迁移, 形成位于外胚层和内胚层中间的新生的中胚层。有一些从原条迁移出来的细胞经过间充质‒上皮转换(epithelial-mesenchymal transition, MET)变成定型内胚层(definitive endoderm, DE, 淡紫色)。DE细胞和部分VE细胞共同构成肠内胚层(Gut endoderm)。
The blastula-stage embryo is formed of two cell populations: trophectoderm (TE, in grey) and inner cell mass (ICM, in beige). Once the embryo implants(E4.5), the ICM differentiates and segregates into primitive endoderm (PrE, in purple) and epiblast (Epi, in red). At E5.5, the embryo shape iscylindrical, and the PrE gives rise to the parietal endoderm (PE, in dark blue) and the visceral endoderm (VE, in blue). VE cells in the distal part of theembryo form the anterior visceral endoderm (AVE), which migrates between E5.5 and E6.0 to one side of the embryonic-extraembryonic border, thereby defining the anterior–posterior axis. At E6.5, gastrulation occurs at the posterior side of the embryo in the primitive streak (PS, in yellow), through an epithelial-mesenchymal transition (EMT). Nascent mesoderm cells move from posterior to anterior, creating a new cell layer between ectoderm and endoderm.Some of the cells that have delaminated through the primitive streak become definitive endoderm (DE, light purple) by mesenchymal-epithelialtransition (MET). Definitive endoderm and some of derivatives of visceral endoderm will contribute to gut endoderm.
图1 小鼠早期胚胎发育(受精卵到原肠胚的形成)示意图(根据参考文献[6]修改)
Fig.1 Mouse early embryo development from zygote to gastrulation (modified from reference [6])
随后, 胚胎经历原肠运动过程。著名发育生物学家Lewis Wolpert曾说: “人生最重要的阶段不是出生和结婚, 甚至不是死亡, 而是原肠运动。”小鼠原肠运动过程是外、中、内三个胚层的形成过程[8], 伴随着剧烈的细胞增殖和细胞迁移, 由此形成的不同胚层成为形态功能各异组织器官的发育基础[3,9-10]。因此, 原肠运动是决定各个胚层形成以及细胞命运图谱最为关键的一个生物学过程[8]。小鼠原肠运动起始的标志, 是在E6.5时期胚胎后部出现原条(primitivestreak, PS)[11]。在原条位置, 上胚层细胞发生上皮‒间充质转换过程(epithelial-mesenchymal transition,EMT)成为间充质细胞, 突破基底膜, 迁移嵌入内脏内胚层和上胚层之间的空隙。这群间充质细胞从胚胎后端向前端迁移, 进而包裹整个胚胎, 形成新生的中胚层(mesoderm, M)和内胚层(endoderm, En)[3], 而留在原来上胚层位置的细胞将发育成外胚层(ectoderm,Ect)(图1)。经过原肠运动, 小鼠胚胎从E6.5时期上胚层的大约660个细胞, 发育到E7.5时期三胚层的16 000多个细胞。细胞通过缩短G1和G2期, 将细胞周期缩短至5小时左右[12] 。E7.5天原肠运动完成,胚胎由单一未分化的上胚层转变成具有复杂细胞组成、形态各异的外、中、内三个胚层。随后胚胎经历器官发生阶段, 外胚层将发育成机体的神经、皮肤等器官, 中胚层将发育成心脏、肌肉和骨骼等器官, 而内胚层将发育成肠、肝、肺和胰腺等器官。因此, 外、中、内三胚层的形成过程对于胚胎模式的建成十分重要。
然而关于小鼠早期胚胎发育, 特别是原肠运动时期的胚层谱系分化及细胞命运决定的分子机制尚不清晰。例如, 关于内胚层的谱系发生过程还存在诸多争议。内脏内胚层包裹胚外外胚层部分被称为胚外内脏内胚层(extraembryonic visceral endoderm,exVE), 包裹上胚层部分被称为胚胎内脏内胚层(embryonic visceral endoderm, emVE), 这两个细胞群体共同组成卵黄囊内胚层。ZORN和WELLS总结大量研究认为, 内胚层和中胚层来自中内胚层的共同前体细胞—中内胚层(mesendoderm)[13]。在原肠运动过程中, 中内胚层前体细胞最早从原条迁移出来, 并伴随中胚层迁移到胚胎前端和两侧,之后发生间充质–上皮转化(mesenchymal-epithelial transition, MET)替换掉内脏内胚层细胞, 发育成定型内胚层(definitive endoderm, DE), 定型内胚层再进一步发育为甲状腺、胸腺、肺、肝、胆、胰腺和肠胃等内脏器官。这些传统观点认为, 原始内胚层衍生的内脏内胚层和脏壁内胚层将发育为胚外组织, 不参与胚胎组织的构成。但近年来通过谱系示踪技术发现, 上胚层来源的细胞并不是完全替换掉原来的内脏内胚层细胞, 而是嵌入到内脏内胚层中[14-15]。这个嵌入过程发生在单个细胞的水平, 最终在内胚层里形成定型内胚层和内脏内胚层组成的马赛克模式, 并且这些内脏内胚层细胞可以参与肠道内胚层的构成。进一步研究发现, 伴随原肠运动的发生, emVE 中Hnf4a 、ApoC2 、Transthyretin和Alphafetoprotein等的表达逐渐下调[16-17], 逐渐失去内脏内胚层细胞的经典形态学特征, 如立方形的细胞形态等。这启示, 胚胎部分的emVE在DE大规模嵌入前就已经失去了exVE的特征。在DE完成嵌入后, emVE和DE细胞都可以参与肠道内胚层(gutendoderm)的产生[18]。
随着单细胞转录组测序技术(single cell RNAseq,scRNA-seq)的发展, 在过去的几年里, scRNAseq被应用鉴定新的细胞类型、研究发育变化的动态过程、探索基因调控机制以及揭示等位基因随机表达情况等[19]。例如, 以爪蟾为模式生物[20], 研究者在不同聚类得到的细胞群体中, 根据时间信息来设置“ancestor voting”, 进而绘制细胞随时间变化的命运图谱, 发现许多细胞命运比之前认为的决定更早, 内胚层与中胚层、外胚层共同从囊胚阶段之后就发生了命运特化。PIJUAN-SALA等[21]使用10×genomics对E6.5至E8.5天的小鼠胚胎进行测序分析,获得了大量胚胎单细胞转录组, 他们分析发现, 内脏内胚层细胞主要参与后肠的形成。CHAN等[22]结合基因编辑技术进行谱系示踪, 揭示了原肠运动期间的谱系转换, 证实内胚层具有两重起源, 分别来自胚外部分和胚胎部分。SONJA等[23]对小鼠E3.5到E8.75时期的所有内胚层细胞经过单细胞转录分析后发现, 在新生肠道内胚层中胚胎来源的和胚外来源的内胚层在空间分布上具有特定的模式, 但整体上相似, 只是保留了其发育来源的一些特征; 并且他们认为, 只有少部分内脏内胚层细胞参与胚胎内胚层的构成[24]。使用索引多重组合策略, CAO等[25]分析了2 000 000个E9.5至E13.5小鼠胚胎单细胞转录组, 结合Monocle 3鉴定了数百种细胞类型和56条细胞谱系发生轨迹。虽然单细胞转录组分析可以重建胚胎细胞的发育轨迹, 但缺乏真实的空间信息,无法将胚胎发育过程中的时间和空间信息联合分析, 而细胞在早期胚胎中的空间位置对其发育分化命运又是至关重要的。
2 时空转录组揭示三胚层谱系发生过程
通过细胞标记移植和谱系追踪等经典方法, 已经建立了粗略的小鼠原肠运动期间胚胎发育的细胞命运图谱[5,26-29]。这些研究发现, 各胚层的前体细胞在原肠胚形成之前的上胚层中具有空间区域化的特征[10,30-31]。此外, 各种组织类型的前体细胞有序分布在特定命运的胚胎区域。沿原条近端‒远端(proximal-distal, P-D)分布的不同位置上胚层细胞随着时间的迁移, 获得不同的细胞命运。根据在原条的不同位置, 中胚层细胞迁移分为两种不同方式: 向近端迁移, 形成胚外中胚层[32]; 向侧面和前端迁移,介于外胚层和内脏内胚层之间, 形成胚胎中胚层[27]。在前端的外胚层细胞也严格按照头尾(craniocaudal)次序, 为神经外胚层及前脑、中脑、后脑的模式建成奠定基础。值得注意的是, 在所有相同发育阶段的脊椎动物胚胎中, 谱系前体细胞具有非常一致的、特定的分布顺序[10-11,33]。因此, 细胞的位置信息对细胞命运调控机制和细胞谱系发生过程的研究十分重要。
早期人们通过全胚胎原位杂交的方式获得特定基因的空间表达信息, 但这种方法通量低, 实验难度大, 难以得到广泛应用。SATIJA等[34]基于已知的原位杂交结果, 并结合单细胞转录组, 开发了Seurat方法, 该算法通过比较每个转录组中表达的基因与从RNA原位杂交获得的几个标志性基因的空间表达模式来推断单细胞转录组的空间位置。但由于具有位置信息的参考坐标基因数量有限, 并且单细胞中表达这些位置参考基因时出现一部分基因表达缺失, 则使得空间定位的成功率大大下降。
我们这些年一直关注空间位置特征对多能干细胞的命运决定关系, 建立了Geo-seq技术, 可以获取到具有空间位置信息的少量细胞转录组[35]。利用这一技术, 我们首先对原肠运动中期—E7.0时期小鼠胚胎的上胚层细胞进行空间转录组构建[36]。我们发现, 此时的小鼠胚胎可以划分为四个空间表达结构域: 胚胎的前、后区域是最显著的两个独立结构域, 也是细胞增殖最为剧烈的结构域, 分别代表了外胚层以及中内胚层的分化命运; 在胚胎的侧面, 根据增殖、代谢等细胞活动差别, 分为近端和远端两个结构域, 反映了胚胎在这个时期能量代谢状态上的独特特征。同时, 我们获得了一套完善的空间位置参考坐标系, 能够将相应发育时期的单细胞回归到胚胎体内的不同位置, 我们称之为Zipcode mapping[36]。运用这个算法, 可以准确将单细胞回归到胚胎的大致区域, 这对单细胞空间分析技术是一个重要的发展。
我们进一步将单个时间点的空间转录组扩展到了小鼠早期胚胎发育的多个时期(E5.5、E6.0、E6.5、E7.0和E7.5), 涵盖胚胎着床后早期到原肠运动晚期, 并包含外、中、内三个胚层所有的细胞谱系, 建立起百科全书式全基因组的时空表达谱数据库(http://egastrulation.sibcb.ac.cn/)[37]。该数据库具有超过20 000个基因的三维分子表达图谱, 一次性揭示了该时期内所有基因的空间动态表达特征。同时,许多新的胚层特异性基因和新的长链非编码RNA被发现和鉴定, 使得小鼠早期胚胎发育中细胞谱系建立的分子调控得到了深入的解析。总之, 此数据库实现了小鼠早期胚胎所有表达基因高分辨率的数字化原位杂交图谱, 具有查询和分析基因的三维表达模式、共表达关系以及根据特征表达模式检索基因等功能, 是目前国际上关于着床后小鼠胚胎最全面、最完整的交互性时空转录组数据库, 为研究细胞微环境对其命运决定提供了翔实的数据, 进而更精细地揭示细胞谱系发生的时空调控机制。
单细胞转录组分析方法SCENIC[38]不是基于单个基因的表达情况, 而是基于多个基因的共表达模块和顺式调节基序推断得到的基因调节网络活性。与基于差异基因表达的分析方法相比, 可以有效避免潜在的批次效应(batch effect), 其得到的结果更加稳健, 并更具有生物学意义。在多时空的胚层发育谱系研究中, 我们利用SCENIC方法, 结合小鼠着床前胚胎的转录组数据, 将发育过程中最重要的时间和空间信息联合分析, 从分子层面构建了小鼠早期胚胎发育过程的系统发生树[37]。我们发现,E2.5~E7.5的Geo-seq样本可分为五组, 分别代表早期胚胎发育过程中的主要细胞谱系, 包括着床前胚胎细胞、上胚层、外胚层、中胚层和内胚层。分析结果显示, 内胚层与上胚层、外胚层和中胚层分离,形成独立的聚类。这表明, 内胚层谱系的发生过程与传统观点认为的内胚层主要来源于中内胚层前体细胞不同, 其谱系分化过程相对独立。同时系统发生树显示, 内胚层类群与着床前胚胎细胞具有更紧密的联系, 暗示内胚层谱系的命运决定过程比之前认为的要早, 而这一发现与一些生物进化研究的结果吻合[39-41]。多细胞生物的胚胎发育过程, 与单细胞生物到多细胞生物的进化历程十分类似。在三个胚层中, 中胚层只在两侧对称的生物中出现, 因此也被认为是在进化中最后形成的胚层[40]。同时有人通过研究线虫在发育过程中时间和空间的基因表达构成, 推断内胚层是最早形成的胚层[39]。他们认为, 在多细胞生物形成过程中, 单细胞生物通过聚集, 形成管状结构来增强对食物的消化能力。这与目前外、中、内三个胚层衍生来的器官功能相符, 即内胚层衍生成消化道及其腺体。我们的研究从“发育‒进化”紧密相连的理论角度, 为内胚层谱系命运提前特化提供了证据。
通过寻找每个时期不同位置的差异表达基因,我们鉴定了不同发育阶段胚胎的空间表达结构域(图2)。我们发现E5.5主要分为两个空间表达结构域, 分别为上胚层和内脏内胚层, 表明此时主要的表达差异是由不同组织类型造成, 而在上胚层或内脏内胚层中不同细胞的基因表达基本一致。内脏内胚层在E6.0时期出现P-D的差异, 此时整个胚胎分为三个空间表达结构域, 分别为上胚层、近端内脏内胚层和远端内脏内胚层。有趣的是, 内胚层在P-D的空间表达差异一直伴随整个原肠运动过程, 在E7.5时期内胚层沿P-D分为三个空间表达结构域(E1、E2和E3)。原肠运动从E6.5起始, 此时原条在形态结构上并不清晰, 但在基因表达上已经形成区别于上胚层的独立表达结构域。中胚层从E7.0时期开始出现,并形成独立的空间表达结构域; 而中胚层在E7.5时期出现A-P差异, 形成前端中胚层(anterior mesoderm,MA)和后端中胚层(posterior mesoderm, MP)两个空间表达结构域。
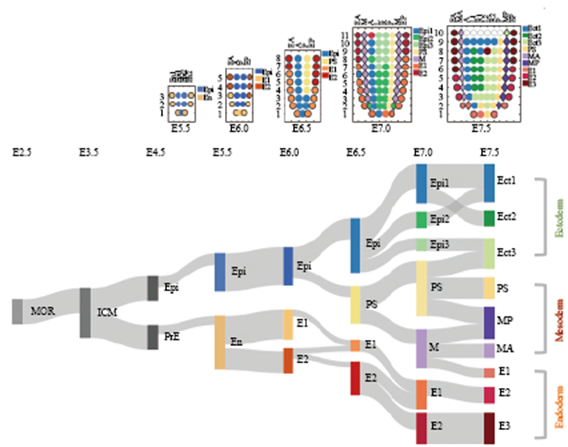
MOR: 桑椹胚; ICM: 内细胞团; Epi: 上胚层; PrE: 原始内胚层; En: 内胚层; E1~3: 内胚层基因表达结构域1~3; Ect1~3: 外胚层; PS: 原条; M: 中胚层; MA: 前端中胚层; MP: 后端中胚层。
MOR: morula; ICM: inner cell mass; Epi: epiblast; PrE: primitive endoderm; En: endoderm; E1-3: endoderm gene expression domain 1-3; Ect1-3: ectoderm1-3; PS: primitive streak; M: mesoderm; MA: anterior mesoderm; MP: posterior mesoderm.
图2 早期胚胎发育时期的空间结构域及其相关性(根据参考文献[37]修改)
Fig.2 The spatial domain of cell populations and the connection of spatial domains based on the correlation of
averaged regulon activities across early developmental stages (modified from reference [37])
通过分析相邻发育阶段胚胎空间结构域的相关性以及调控关系, 我们发现, 中胚层和外胚层的谱系发生过程紧密相关。在转录调控层面, 中胚层的调控网络与原条的调控网络相近, 并与外胚层共同来源于早期的上胚层。而内胚层谱系的发生与中胚层和外胚层谱系的发生有较大差异, 形成鲜明的相对独立的发生过程。E7.5时期的多数内胚层细胞(E2和E3区域的细胞)与原始内胚层具有紧密关系, 表明内胚层谱系的细胞命运较早特化。这一发现首次从分子层面提示, 除了之前研究认为的内胚层来源于中内胚层前体细胞外, 内胚层的另一个更重要的可能来源是早期的内脏内胚层细胞。我们的研究还发现, 只有少部分E1区域的内胚层细胞与E7.0的中胚层具有发育上的相关性, 共享很多相同的调控网络,这提示, E7.0时期部分中胚层细胞发生向内胚层命运转变或可能存在中内胚层前体细胞[37]。进一步,结合我们E7.0时期的内胚层单细胞分析发现, E7.0时期的内胚层也分为三个类群, 其中一个类群表达原条特异基因T和Mixl1等, 因此, 这些研究结果提示, 在哺乳动物胚胎发育中充满争议的“中内胚层前体”可能是存在的。此外, 我们还发现, 部分外胚层和中胚层具有共同的前体细胞。在系统发生树和降维分析中都可以发现, 部分外胚层和中胚层具有紧密联系; 在转录因子调控网络中也发现, E7.5中的侧面后端Ect3与MP共同来源于E7.0时期的PS。这暗示,外胚层中胚层前体细胞存在的可能, 也为后续鉴定中内胚层前体细胞和多能干细胞向中胚层、内胚层器官分化提供了新的思路。
进一步, 我们通过信号通路富集分析发现, 在早期内胚层表达的转录调控网络G3存在Hippp/Yap信号的特异性激活。功能实验也证实, 在内脏内胚层中加入Yap抑制剂后, 对于内胚层早期发生过程重要的G3调控网络出现显著下调, 提示Hippp/Yap信号在早期内胚层发育过程中具有重要作用。同时, 我们也找到了许多在胚层谱系发生过程中关键的转录因子, 并系统全面地绘制了早期胚胎发育过程中, 谱系 建立的关键信号调控网络图谱。这为理解体内细胞命运调控机制和体外建立应用模型等提供了新的思路。
总而言之, 我们的研究首次构建了小鼠三个胚层谱系发生过程中的高分辨率时空转录组图谱, 揭示了多能干细胞的分子谱系和多能性在时间和空间上的动态变化及其调控网络。首次从分子层面揭示了内胚层谱系发生的新来源, 提出外胚层和中胚层具有共同前体的新观点, 建立了小鼠早期胚胎三胚层细胞谱系分化的新理论; 并阐释了Hippo/Yap信号通路在早期胚胎发育期间参与内胚层发育的新功能。这项工作为理解胚层谱系建立及多能干细胞的命运调控机制, 提供了翔实的数据和崭新的思路, 是对经典发育生物学层级谱系理论的重大修正和补充, 有望大大推动早期胚胎发育和干细胞再生医学相关领域的发展。
参考文献 (References)
[1] SULSTON J E, SCHIERENBERG E, WHITE J G, et al. The embryoniccell lineage of the nematode Caenorhabditis elegans [J]. Dev Biol, 1983, 100(1): 64-119.
[2] CARROLL S B. Evo-devo and an expanding evolutionary synthesis:a genetic theory of morphological evolution [J]. Cell,2008, 134(1): 25-36.
[3] TAM P P, LOEBEL D A. Gene function in mouse embryogenesis:get set for gastrulation [J]. Nat Rev Genetics, 2007, 8(5):368-81.
[4] NIAKAN K K, EGGAN K. Analysis of human embryos fromzygote to blastocyst reveals distinct gene expression patterns relative to the mouse [J]. Dev Biol, 2013, 375(1): 54-64.
[5] TAKAOKA K, HAMADA H. Cell fate decisions and axis determinationin the early mouse embryo [J]. Development, 2012,139(1): 3-14.
[6] NAHABOO W, MIGEOTTE I. Cleavage and gastrulation in the mouse embryo [J]. eLS, 2018: 1-6.
[7] STOWER M J, SRINIVAS S. Heading forwards: anterior visceralendoderm migration in patterning the mouse embryo [J].Philos Transactions R Soc London B Biol Sci, 2014, 369(1657):
20130546.
[8] TAM P, LOEBEL D. Specifying mouse embryonic germ cells [J].Cell, 2009, 137: 398-400.
[9] SOLNICA-KREZEL L, SEPICH D S. Gastrulation: making and shaping germ layers [J]. Annual Rev Cell Deve Biol, 2012, 28:687-717.
[10] TAM P P, BEHRINGER R R. Mouse gastrulation: the formation of a mammalian body plan [J]. Mech Dev, 1997, 68(1/2): 3-25.
[11] TAM P P, WILLIAMS E A, CHAN W Y. Gastrulation in the mouse embryo: ultrastructural and molecular aspects of germ layer morphogenesis [J]. Micro Res Tech, 1993, 26(4): 301-28.
[12] FOSSAT N, JONES V, GARCIA-GARCIA M J, et al. Modulationof WNT signaling activity is key to the formation of the embryonic head [J]. Cell Cycle, 2012, 11(1): 26-32.
[13] ZORN A M, WELLS J M. Vertebrate endoderm development and organ formation [J]. Annual Rev Cell Deve Biol, 2009, 25: 221-51.
[14] VIOTTI M, NOWOTSCHIN S, HADJANTONAKIS A K.SOX17 links gut endoderm morphogenesis and germ layer segregation[J]. Nat Cell Biol, 2014, 16(12): 1146-56.
[15] KWON G S, VIOTTI M, HADJANTONAKIS A K. The endoderm of the mouse embryo arises by dynamic widespread intercalation of embryonic and extraembryonic lineages [J]. Dev Cell,2008, 15(4): 509-20.
[16] VIOTTI M, NOWOTSCHIN S, HADJANTONAKIS A K. Afp:mCherry, a red fluorescent transgenic reporter of the mouse visceralendoderm [J]. Genesis, 2011, 49(3): 124-33.
[17] KWON G S, HADJANTONAKIS A K. Transthyretin mousetransgenes direct RFP expression or Cre-mediated recombination throughout the visceral endoderm [J]. Genesis, 2009, 47(7): 447-55.
[18] VIOTTI M, NIU L, SHI S H, et al. Role of the gut endoderm inrelaying left-right patterning in mice [J]. PLoS Biol, 2012, 10(3):e1001276.
[19] HEDLUND E, DENG Q. Single-cell RNA sequencing: Technical advancements and biological applications [J]. Mol Aspects Med,2018, 59: 36-46.
[20] BRIGGS J A, WEINREB C, WAGNER D E, et al. The dynamicsof gene expression in vertebrate embryogenesis at single-cell resolution [J]. Science, 2018, 360(6392): eaar5780.
[21] PIJUAN-SALA B, GRIFFITHS J A, GUIBENTIF C, et al. A single-cell molecular map of mouse gastrulation and early organogenesis [J]. Nature, 2019, 566(7745): 490.
[22] CHAN M M, SMITH Z D, GROSSWENDT S, et al. Molecular recording of mammalian embryogenesis [J]. Nature, 2019, 570(7759): 77-82.
[23] NOWOTSCHIN S, SETTY M, KUO Y Y, et al. The emergent landscape of the mouse gut endoderm at single-cell resolution [J]. Nature, 2019, 569(7756): 361.
[24] NOWOTSCHIN S, HADJANTONAKIS A K, CAMPBELL K. The endoderm: a divergent cell lineage with many commonalities [J]. Development, 2019, 146(11): dev150920.
[25] CAO J, SPIELMANN M, QIU X, et al. The single-cell transcriptional landscape of mammalian organogenesis [J]. Nature, 2019, 566(7745): 496-502.
[26] TAM P P, LOEBEL D A, TANAKA S S. Building the mouse gastrula: signals, asymmetry and lineages [J]. Cur Opinion Gene Dev, 2006, 16(4): 419-25.
[27] PARAMESWARAN M, TAM P P. Regionalisation of cell fate and morphogenetic movement of the mesoderm during mouse gastrulation [J]. Dev Gene, 1995, 17(1): 16-28.
[28] LAWSON K A, PEDERSEN R A. Cell fate, morphogenetic movement and population kinetics of embryonic endoderm at the time of germ layer formation in the mouse [J]. Development, 1987, 101(3): 627-52.
[29] LAWSON K A, MENESES J J, PEDERSEN R A. Clonal analysis of epiblast fate during germ layer formation in the mouse embryo [J]. Development, 1991, 113(3): 891-911.
[30] BEDDINGTON R S. An autoradiographic analysis of tissue potency in different regions of the embryonic ectoderm during gastrulation in the mouse [J]. J Embryol Exp Morphol, 1982, 69:265-85.
[31] BEDDINGTON R S. An autoradiographic analysis of the potency of embryonic ectoderm in the 8th day postimplantation mouse embryo [J]. J Embryol Exp Morphol, 1981, 64: 87-104.
[32] KINDER S J, TSANG T E, QUINLAN G A, et al. The orderly allocation of mesodermal cells to the extraembryonic structures and the anteroposterior axis during gastrulation of the mouse embryo [J]. Development, 1999, 126(21): 4691-701.
[33] SOLNICA-KREZEL L. Conserved patterns of cell movements during vertebrate gastrulation [J]. Cur Biol, 2005, 15(6): R213- 28.
[34] SATIJA R, FARRELL J A, GENNERT D, et al. Spatial reconstruction of single-cell gene expression data [J]. Nat Biotechnol, 2015, 33(5): 495-502.
[35] CHEN J, SUO S, TAM P P, et al. Spatial transcriptomic analysis of cryosectioned tissue samples with Geo-seq [J]. Nat Protocols, 2017, 12(3): 566-80.
[36] PENG G, SUO S, CHEN J, et al. Spatial transcriptome for the molecular annotation of lineage fates and cell identity in midgastrula mouse embryo [J]. Dev Cell, 2016, 36(6): 681-97.
[37] PENG G, SUO S, CUI G, et al. Molecular architecture of lineage allocation and tissue organization in early mouse embryo [J]. Nature, 2019, 572(7770): 528-32.
[38] AIBAR S, GONZALEZ-BLAS C B, MOERMAN T, et al. SCENIC: single-cell regulatory network inference and clustering [J]. Nat Methods, 2017, 14(11): 1083-6.
[39] HASHIMSHONY T, FEDER M, LEVIN M, et al. Spatiotemporal transcriptomics reveals the evolutionary history of the endoderm germ layer [J]. Nature, 2015, 519(7542): 219-22.
[40] RYAN J F, PANG K, SCHNITZLER C E, et al. The genome of the ctenophore Mnemiopsis leidyi and its implications for cell type evolution [J]. Science, 2013, 342(6164): 1242592.
[41] MARTINDALE M Q, PANG K, FINNERTY J R. Investigating the origins of triploblasty: ‘mesodermal’ gene expression in a diploblastic animal, the sea anemone Nematostella vectensis (phylum, Cnidaria; class, Anthozoa) [J]. Development, 2004, 131(10): 2463-74.



 中文版
中文版 英文版
英文版