领域前沿·中国
肿瘤相关巨噬细胞作为乙酸供应源促进肝癌细胞侵袭转移
沈立 鲁明*
(脂质代谢与肿瘤微环境组, 中国科学院上海营养与健康研究所, 中国科学院大学, 上海 200031)
| 鲁明, 中国科学院上海营养与健康研究所研究员。2004年本科毕业于四川大学;2010年于中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)获得博士学位; 2011年至2014年在中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)从事博士后研究; 2014年至2021年于复旦大学附属华山医院普外科/复旦大学肿瘤转移研究所担任助理/副研究员; 2018年至2020年以访问学者身份于美国杰克逊实验室交流学习。2021年春季入职中国科学院上海营养与健康研究所任研究员。鲁明研究组主要从事脂质代谢物感知与肿瘤转移研究, 代表性研究工作在Cancer Cell、Cell Metab、Nat Immunol、Nat Metab等国际学术期刊上发表。 |
肿瘤相关巨噬细胞作为乙酸供应源促进肝癌细胞侵袭转移
沈立 鲁明*
(脂质代谢与肿瘤微环境组, 中国科学院上海营养与健康研究所, 中国科学院大学, 上海 200031)
【摘要】代谢重编程是肿瘤进展与转移的核心驱动力之一。其中, 乙酰辅酶A的累积被认为是转移性癌细胞关键的代谢特征之一。已知从乙酸合成乙酰辅酶A是多种类型癌细胞维持高水平乙酰辅酶A的主要代谢途径。然而, 癌细胞大量摄取乙酸的来源尚不清楚。针对这个科学问题, 研究团队使用肝癌(HCC)体内外模型进行研究发现, 肿瘤相关巨噬细胞(TAMs)可特异性引起肝癌细胞乙酸累积。进一步机制研究发现, TAMs通过激活脂质过氧化–乙醛脱氢酶2(ALDH2)途径来增加其乙酸的生成, 并以游离形式将乙酸分泌到微环境中使其被肝癌细胞摄取。机制方面, TAMs来源的乙酸促进肝癌细胞体外迁移的效应主要是通过合成乙酰辅酶A进而增强组蛋白H3乙酰化(H3ac)和上皮-间质转化(EMT)过程来完成。抑制ALDH2或脂质过氧化途径可显著减弱TAMs来源乙酸的促迁移效应。在小鼠肝癌原位移植瘤模型中, TAMs特异性敲除ALDH2可显著抑制肝癌的肺转移。最后, 筛选验证发现肝癌细胞来源的乳酸可通过增加活性氧(ROS)水平激活TAMs的脂质过氧化-ALDH2途径。这一研究揭示了肝癌细胞与TAMs之间“乳酸–脂质过氧化–乙酸”的全新代谢互作模式, 阐明了TAMs作为微环境乙酸供应源促进肝癌转移的机制, 提示了TAMs的ALDH2可作为抗肝癌转移的新靶点。
【关键词】乙酸; 肿瘤相关巨噬细胞; ALDH2; 肝癌转移; 乳酸
Tumor-Associated Macrophages Serve as an Acetate Reservoir to Drive Hepatocellular Carcinoma Metastasis
SHEN Li, LU Ming*
(Laboratory of Lipid Metabolism and Tumor Microenvironment, Shanghai Institute of Nutrition and Health, University of Chinese Academy of Sciences, Shanghai 200031, China)
【Abstract】Metabolic reprogramming is a cardinal driver of tumor progression and metastasis. Accumulation of acetyl-CoA has emerged as a pervasive metabolic hallmark of metastatic cancers. While many malignant cells avidly import acetate to sustain high acetyl-CoA pools, the cellular source of extracellular acetate remains enigmatic. Here, using orthotopic and cell-based HCC (hepatocellular carcinoma) models, the researchers demonstrate that TAMs (tumor-associated macrophages) are both necessary and sufficient to trigger acetate accumulation in malignant hepatocytes. Mechanistically, TAMs activate a lipid peroxidation-ALDH2 (aldehyde dehydrogenase 2) axis that converts lipid-derived aldehydes into acetate, which is subsequently released and is taken up by HCC cells. TAMs-derived acetate fuels acetyl-CoA synthesis, thereby enhancing H3ac (H3 acetylation) and potentiating EMT (epithelial-to-mesenchymal transition) and HCC cell motility in vitro. Genetic or pharmacologic blockade of ALDH2 or lipid peroxidation abrogates the pro-migratory activity of TAMs-secreted acetate. Moreover, TAMsspecific deletion of ALDH2 in an orthotopic mouse model markedly reduced lung metastasis of HCC. Finally, the researchers identify tumor cell-derived lactate as the initiating signal that elevates ROS (reactive oxygen species) levels in TAMs, thereby igniting the lipid peroxidation-ALDH2 pathway. These findings unveil a previously unrecognized“lactate-lipid peroxidation-acetate” metabolic circuitry between HCC cells and TAMs, establish TAMs as a critical acetate supplier within the tumor microenvironment, and nominate macrophage ALDH2 as a tractable therapeutic target for preventing HCC metastasis.
【Keywords】acetate; tumor-associated macrophages; ALDH2; hepatocellular carcinoma metastasis; lactate
1 微环境中是否存在乙酸的其他来源?
乙酰辅酶A是细胞内关键的代谢中间物[1]。细胞内乙酰辅酶A主要由糖酵解、脂肪酸β-氧化和支链氨基酸的分解产生[2-5], 而乙酰辅酶A的分解主要由酰基辅酶A硫酯酶12(acyl-CoA thioesterase 12,ACOT12)负责, 它可催化乙酰辅酶A水解生成乙酸和辅酶A(图1)。细胞内的乙酰辅酶A不仅可用于脂质的从头合成, 更重要的是, 作为蛋白质乙酰化反应中乙酰基的供体, 细胞内乙酰辅酶A的含量与组蛋白乙酰化水平存在动态关联, 从而通过表观遗传调控机制影响基因的表达调控[6]。已有的报道显示, 在多种癌症中, 高乙酰辅酶A水平是转移性癌细胞的关键代谢特征, 在乳腺癌中, 乙酰辅酶A羧化酶1(acetyl-CoA carboxylase 1, ACC1)的抑制会提高细胞内乙酰辅酶A水平, 进而增强SMAD家族成员2(SMAD family member 2, Smad2)转录因子的乙酰化, 激活并诱导上皮–间充质转化(epithelial-to-mesenchymal transition,EMT)相关基因表达, 加速转移的发生[7]; 在胶质母细胞瘤中, 柠檬酸裂解酶(ATP-citrate lyase, ACLY)依赖的乙酰辅酶A累积可通过上调组蛋白H3第27位赖氨酸的乙酰化[acetyl-Histone H3 (Lys27), H3K27ac]水平促进细胞迁移和黏附相关基因的表达, 进而增强胶质母细胞瘤细胞的迁移能力[8]; 在前列腺癌中,乙酰辅酶A可调节依赖钙离子/钙调蛋白的蛋白激酶II(calcium/calmodulin-dependent protein kinase II,CaMKII)的激活, 促进前列腺癌细胞的存活和转移[9];而本研究团队的前期研究也发现ACOT12依赖的乙酰辅酶A累积可通过表观激活twist家族bHLH转录因子2(twist family bHLH transcription factor 2, TWIST2)基因的表达, 增强肝癌细胞的迁移能力[10]。此外, 为了维持高水平的乙酰辅酶A, 癌细胞会大量摄取乙酸, 并通过乙酰辅酶A合成酶1(acetyl-CoA synthetase1, ACSS1)或乙酰辅酶A合成酶2(acetyl-CoA synthetase2, ACSS2)将其合成乙酰辅酶A[11-12](图1)。利用癌细胞的这一特性, 临床开发了基于11C-乙酸示踪剂的正电子发射断层扫描–计算机断层扫描(positron emission tomography-computed tomography, PET-CT)检查方法, 可在前列腺癌、肝细胞癌、肾细胞癌和神经胶质瘤等多种癌种中实现对肿瘤组织的临床诊断[13-15]。利用稳定同位素示踪技术在胶质瘤动物模型的实验研究中也可观察到, 在胶质母细胞瘤的脑转移瘤中, 癌细胞大量摄取乙酸并通过ACSS2进入细胞“乙酰辅酶A池”中, 进一步乙酰辅酶A进入三羧酸循环被氧化来满足脑肿瘤恶性生长的高生物合成和能量需求[12]。此外, 在多种癌种中, 乙酸可作为乙酰辅酶A的底物来源, 通过提高组蛋白H3的乙酰化水平(特别是H3K9、H3K27和H3K56), 激活脂质生成基因ACC1和脂肪酸合酶(fatty acid synthase,FASN)的表达, 从而促进脂质的从头合成, 提高癌细胞在缺氧应激下的存活能力[11]。以上表明乙酸作为乙酰辅酶A主要底物来源在促进肿瘤恶性进展中发挥着重要作用。尽管这些已有的研究已充分显示出癌细胞摄取乙酸合成乙酰辅酶A这条代谢途径的重要作用, 但癌细胞所摄取乙酸的来源这个问题一直没有明确的答案。因此, 探寻癌细胞获取乙酸的来源对于深入解析癌细胞乙酰辅酶A代谢调控机制具有重要的意义, 并可为癌转移的干预提供新的潜在靶点。
在人体内, 肠道菌群分解膳食纤维及肝脏对酒精氧化解毒过程是乙酸产生的主要途径[16]。此外, 脂质过氧化产生的醛类物质也可通过依赖于醛脱氢酶(aldehyde dehydrogenase, ALDH)的分解途径生成乙酸[17](图1)。在健康个体血浆中乙酸水平通常较低, 一般在50 μmol/L至200 μmol/L[16]之间; 然而, 在肝癌组织中乙酸水平达到了500 μmol/L至2 mmol/L[11], 胰腺癌组织中的乙酸水平更高达700 μmol/L至2.5 mmol/L[18]。鉴于肿瘤主要通过周围浸润的血管来获取其生长所必需的营养物质, 但肿瘤组织中乙酸水平, 远高于其在血浆中的水平, 提示肿瘤微环境中存在乙酸的其他来源。
肿瘤微环境由多种非恶性细胞组成, 包括免疫细胞、肿瘤相关成纤维细胞(cancer associated fibroblasts fibroblasts,CAFs)、内皮细胞和其他组织驻留细胞[19]。肿瘤细胞与免疫细胞或基质细胞之间的代谢相互作用决定了局部代谢物的可利用性, 并影响肿瘤进展[20]。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是肿瘤微环境中含量最为丰富的一种免疫细胞[21]。TAMs浸润程度与多种肿瘤类型的患者不良预后密切相关[22-24]。TAMs通过产生生长因子和蛋白水解酶、刺激血管生成以及抑制细胞毒性T细胞, 在促进肿瘤转移过程中发挥关键作用[25]。巨噬细胞可以通过代谢途径转换来实现向炎症(M1)或调节(M2)亚型的极化。近期研究表明, TAMs同时具有M1和M2极化的特征, 并且代谢改变是TAMs不同功能状态的关键决定因素[26-27]。然而, TAMs代谢改变对肿瘤细胞局部代谢物可用性及肿瘤转移的影响尚不明确。
本研究探讨了肝癌细胞中乙酸累积的微环境调控机制, 明确了TAMs为肝癌微环境中的乙酸供应源, 探究了TAMs中乙酸产生和分泌的机制, 并揭示了TAMs来源的乙酸在肝癌转移中的功能作用[28]。
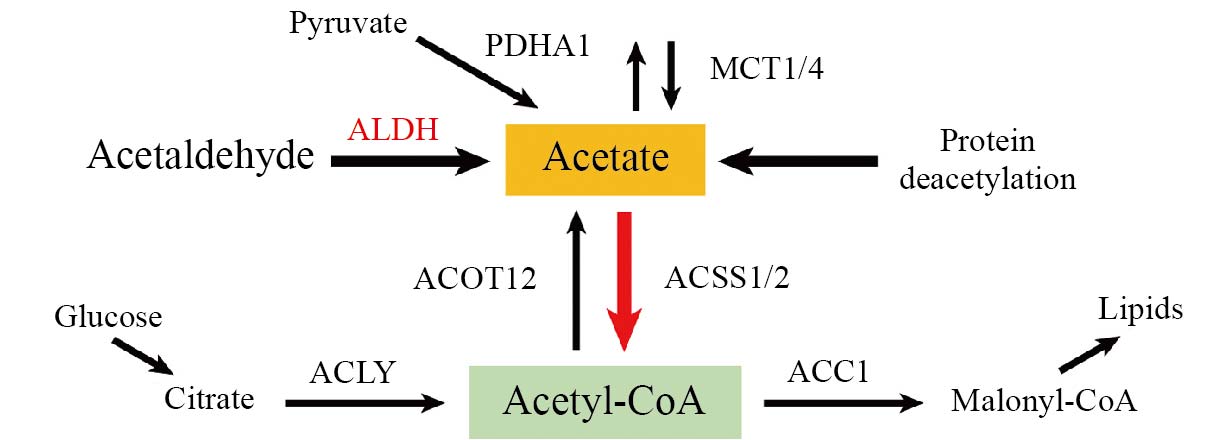
图1 细胞内乙酸和乙酰辅酶A代谢通路
Fig.1 Intracellular metabolic pathways of acetate and acetyl-CoA
2 筛选并鉴定TAMs可诱导肝癌细胞乙酸累积
为探究HCC细胞中乙酸积累的微环境调控机制, 我们首先在肝原位小鼠模型中检测HCC肿瘤组织与正常肝组织的乙酸水平, 发现肝癌组织及肿瘤来源间质液中的乙酸水平均高于对应的邻近正常肝组织。进一步对肝癌微环境中的不同的原代免疫细胞和基质细胞进行筛选, 实验结果显示, 只有与TAMs共培养后, HCC细胞内的乙酸和H3ac水平才显著升高, 与肿瘤相关中性粒细胞或CD45⁻非肿瘤细胞共培养则无此效应。为了在体内验证TAMs对HCC细胞乙酸积累的作用, 我们进一步使用氯膦酸盐脂质体在肝原位小鼠模型中选择性敲除TAMs, 结果显示, 原代HCC细胞的胞内乙酸水平显著降低。此外, 使用体外诱导的TAMs进行分析验证, 也同样发现TAMs可特异性促进肝癌细胞乙酸水平的提高。这些结果表明, TAMs在体内外均可促进HCC细胞中乙酸的积累。
3 TAMs通过“脂质过氧化-ALDH2”轴来增加乙酸的生成, 并以游离形式将其分泌到微环境中
为了揭示TAMs诱导肝癌细胞乙酸累积的具体机制, 我们首先检测了使用TAMs条件培养基(TAMs-CM)处理前后肝癌细胞中乙酸代谢相关基因的表达, 发现处理前后无明显变化。进一步通过靶向代谢组学和超滤等方式, 我们发现TAMs分泌的乙酸主要以代谢物的形式存在, 表明TAMs分泌乙酸到微环境中进而被肝癌细胞摄取导致其乙酸累积。
接下来, 我们开始探究是什么代谢通路的改变导致TAM分泌乙酸增加呢?我们检测发现两个乙醛代谢基因ALDH2和ALDH1B1在人、鼠源TAMs中的表达都显著上调。进一步探究证实, 只有抑制ALDH2才能显著降低TAMs分泌的乙酸水平。这表明ALDH2在TAMs产生乙酸过程中起着关键作用。
ALDH2是肝脏中将乙醇衍生的乙醛转化为乙酸的关键酶[29]。此外, ALDH2还可氧化脂质过氧化过程产生的乙醛[30-31]。据报道在肿瘤微环境中TAMs存在脂质积累[32-33], 因此我们推测TAMs可能通过脂质过氧化-ALDH2途径产生乙酸。首先, 检测TAMs中脂质过氧化关键中间代谢物丙二醛(malondialdehyde,MDA)水平[30], 发现其相较M0型巨噬细胞(macrophages, MΦs)显著升高。除非酶促过程外, MDA还可通过环氧酶1/2(cyclooxygenase 1/2,COX1/COX2)依赖的酶促过程产生。检测发现两者的mRNA水平在TAMs中也较MΦs显著升高。进一步使用脂质过氧化探针检测同样发现, TAMs相较MΦs脂质过氧化水平显著升高。这些结果表明TAMs中脂质过氧化通路被激活。为了验证TAMs中脂质过氧化水平升高是否导致其乙酸生成, 我们使用了两种抗氧化剂铁抑素1(ferrostatin-1, Fer-1)和N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine, NAC)以及COX1/COX2双重抑制剂阿司匹林(Aspirin)处理, 发现抑制脂质过氧化能显著降低TAMs分泌的乙酸水平。以上结果表明TAMs通过激活脂质过氧化来增加其乙酸生成。
进一步, 我们使用代谢物示踪技术进行验证。已知亚油酸在细胞内可代谢为花生四烯酸(arachidonic acid, AA)[34-35], 且近期研究表明, 在脂质过氧化过程中, AA或肾上腺酸而非亚油酸是被氧化的主要多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)[36-37]。因此, 我们利用全碳标的亚油酸进行示踪实验。结果显示, 与全碳标的亚油酸孵育后, 超过90%的亚油酸被稳定同位素标记, 同时15.6%的AA和9.93%的分泌乙酸被标记。为排除脂肪酸β氧化途径对乙酸生成的影响, 使用肉碱棕榈酰转移酶1a(carnitine palmitoyltransferase 1a, CPT1a)抑制剂依托莫斯(Etomoxir)抑制β氧化过程, 结果显示, Etomoxir处理条件下, 20.61%的AA和9.03%的分泌乙酸被标记, 这表明43.83 (9.03/20.61)的分泌乙酸来源于AA的脂质过氧化途径。这些结果表明脂质过氧化-ALDH2通路负责TAMs中的乙酸生成。
4 靶向TAMs的ALDH2可抑制肝癌肺转移
前期研究表明, 外源性乙酸可通过提高细胞内乙酰辅酶A水平增强肝癌细胞迁移能力。接下来, 通过抑制TAMs中ALDH2或脂质过氧化途径, 进一步探究TAMs来源的乙酸的促肝癌细胞迁移能力是否受到影响。结果显示, 与TAMs共培养或使用TAMs-CM处理均可促进肝癌细胞迁移, 而抑制TAMs中ALDH2或脂质过氧化均会显著减弱TAMs的促迁移能力。并且, 在TAMs-CM中回补高浓度外源性乙酸能够消除ALDH2敲低对TAMs促迁移能力的抑制作用, 表明ALDH2敲低是通过减少乙酸分泌来抑制TAMs的促迁移能力。并且与先前的机制一致, 我们发现, 抑制乙酸合成乙酰辅酶A途径,或者抑制组蛋白乙酰转移酶都能显著减弱TAMs的促迁移作用, 表明TAMs分泌的乙酸通过合成乙酰辅酶A进而提高H3ac水平和促进EMT过程来促进肝癌细胞迁移。
接下来, 为了在体内探究TAMs源性乙酸在肝癌转移中的作用, 我们在髓系特异性敲除Aldh2和对照小鼠中构建了肝原位模型。结果显示, 髓系敲除Aldh2后小鼠的肺转移显著减少, 并且原代肝癌细胞中的乙酸水平也显著降低。此外, 通过流式细胞术检测发现Aldh2的敲除并不影响TAMs的极化状态及其他免疫细胞在肿瘤微环境中的浸润。上述结果表明在体内抑制TAMs的ALDH2也能明显地抑制肝癌转移。以上体内外研究获得的机制研究结果在人肝癌样本中也得到了验证, 利用多重免疫荧光技术, 我们发现人肝癌组织样本中ALDH2+ TAMs浸润程度与临近肝癌细胞组蛋白乙酰化水平呈正相关。
5 肝癌细胞来源的乳酸可激活TAMs中“脂质过氧化-ALDH2”轴
接下来, 我们开始探究TAMs中ALDH2上调的具体机制, 首先, 使用HCC细胞来源的条件培养基或热灭活的条件培养基处理, 我们发现肝癌细胞分泌的代谢物可激活TAMs中ALDH2的表达。进一步,使用癌细胞来源的几种常见的代谢物处理, 我们发现只有乳酸处理能显著提高巨噬细胞中ALDH2的表达以及MDA和脂质过氧化水平。最后, 我们鉴定出HCC细胞来源的乳酸可通过提高活性氧(reactive oxygen species, ROS)水平和上调核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, NRF2)的表达激活TAMs的脂质过氧化-ALDH2途径, 从而形成肝癌细胞和TAMs之间“乳酸–脂质过氧化–乙酸”的互作环路。
6 总结与展望
本研究系统阐明了TAMs通过脂质过氧化-ALDH2通路大量生成和分泌乙酸的机制, 为HCC细胞持续提供乙酸底物。HCC细胞摄取TAMs来源的乙酸后, 促进乙酰辅酶A生成和H3ac水平提高, 激活EMT相关基因表达, 从而增强其迁移和转移能力。抑制TAMs中的ALDH2表达或脂质过氧化, 可有效降低TAMs乙酸分泌和HCC细胞转移潜能, 这在动物模型和临床样本中均得到验证(图2)。该工作首次揭示了肿瘤微环境免疫细胞代谢活动对癌细胞乙酸代谢和转移潜能的直接调控, 提示了以TAMs-ALDH2通路为靶点的代谢干预有望成为防治肝癌转移的新策略, 并丰富了肿瘤免疫–代谢互作领域的理论基础。
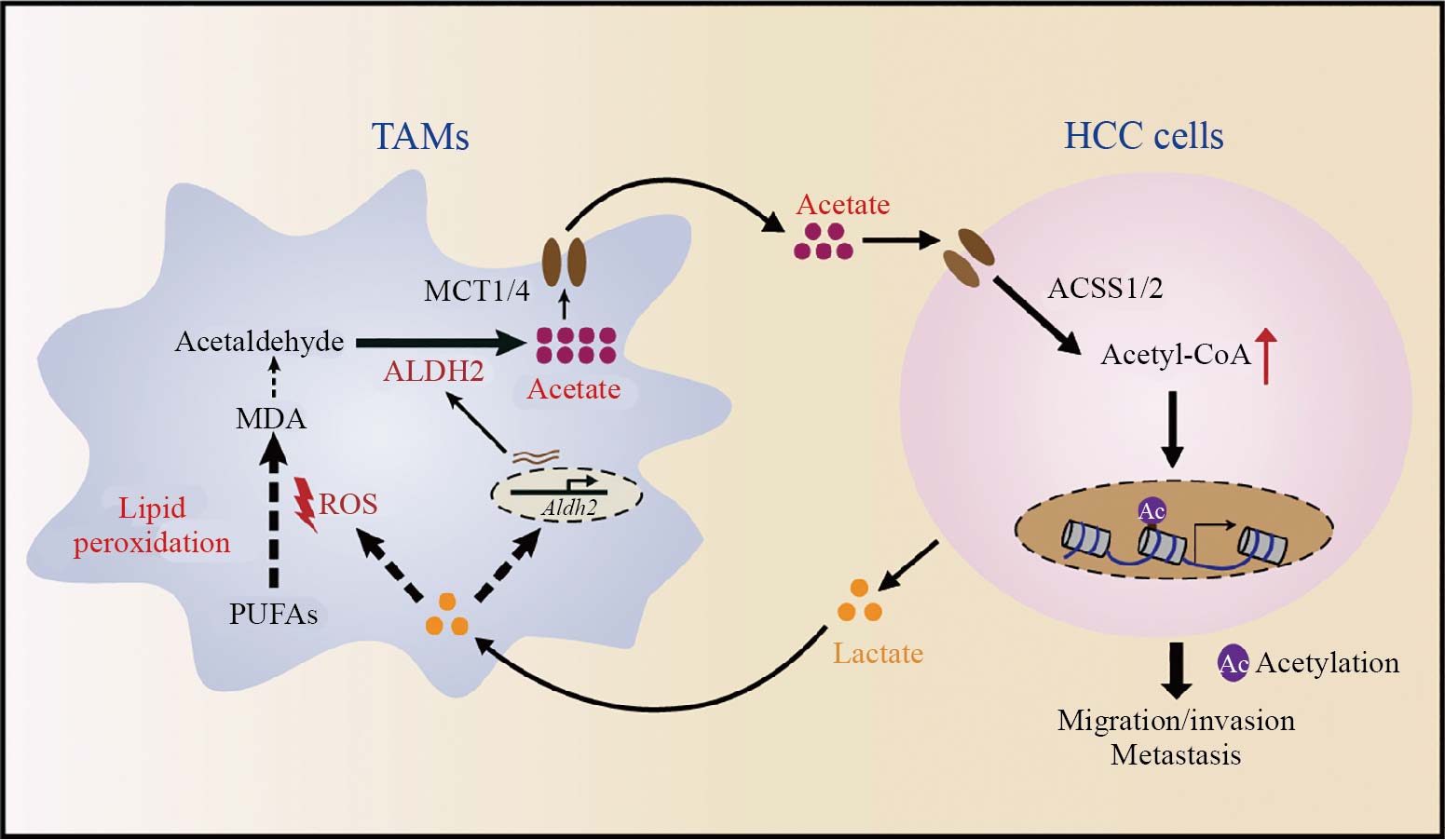
图2 TAMs与肝癌细胞间的“乳酸-NOX1-ROS-NRF2-ALDH2-乙酸”代谢互作模式(根据参考文献[28]修改)
Fig.2 The “lactate-NOX1-ROS-NRF2-ALDH2-acetate” metabolic crosstalk model between TAMs and HCC (modified from reference [28])
参考文献 (References)
[1] NAGARSHETH N, WICHA M S, ZOU W P. Chemokines in the cancer microenvironment and their relevance in cancer immunotherapy [J]. Nat Rev Immunol, 2017, 17(9): 559-72.
[2] BISWAS S K. Metabolic reprogramming of immune cells in cancer progression [J]. Immunity, 2015, 43(3): 435-49.
[3] MARTINEZ F O, GORDON S. The M1 and M2 paradigm of macrophage activation: time for reassessment [J]. F1000 Prime Rep, 2014, 6: 13.
[4] MURRAY P J, ALLEN J E, BISWAS S K, et al. Macrophage activation and polarization: nomenclature and experimental guidelines [J]. Immunity, 2014, 41(1): 14-20.
[5] NOVIKOVA M V, KHROMOVA N V, KOPNIN P B. Components of the hepatocellular carcinoma microenvironment and their role in tumor progression [J]. Biochemistry, 2017, 82(8): 861-73.
[6] PIETROCOLA F, GALLUZZI L, BRAVO-SAN PEDRO J M, et al. Acetyl coenzyme A: a central metabolite and second messenger [J]. Cell Metab, 2015, 21(6): 805-21.
[7] GARCIA M R, STEINBAUER B, SRIVASTAVA K, et al. Acetyl-CoA carboxylase 1-dependent protein acetylation controls breast cancer metastasis and recurrence [J]. Cell Metab, 2017, 26(6): 842-55,e5.
[8] LEE J V, BERRY C T, KIM K, et al. Acetyl-CoA promotes glioblastoma cell adhesion and migration through Ca2+-NFAT signaling [J]. Gene Dev, 2018, 32(7/8): 497-511.
[9] YU G Y, CHENG C J, LIN S C, et al. Organelle-derived acetyl-CoA promotes prostate cancer cell survival, migration, and metastasis via activation of calmodulin kinase II [J]. Cancer Res, 2018, 78(10): 2490-502.
[10] LU M, ZHU W W, WANG X, et al. ACOT12-dependent alteration of acetyl-CoA drives hepatocellular carcinoma metastasis by epigenetic induction of epithelial-mesenchymal transition [J]. Cell Metab, 2019, 29(4): 886-900,e5.
[11] GAO X, LIN S H, REN F, et al. Acetate functions as an epigenetic metabolite to promote lipid synthesis under hypoxia [J]. Nat Commun, 2016, doi: 10.1038/ncomms11960.
[12] MASHIMO T, PICHUMANI K, VEMIREDDY V, et al. Acetate is a bioenergetic substrate for human glioblastoma and brain metastases [J]. Cell, 2014, 159(7): 1603-14.
[13] GRASSI I, NANNI C, ALLEGRI V, et al. The clinical use of PET with (11)C-acetate [J]. Am J Nucl Med Mol Imaging, 2012, 2(1): 33-47.
[14] PARK J W, KIM J H, KIM S K, et al. A prospective evaluation of 18F-FDG and 11C-acetate PET/CT for detection of primary and metastatic hepatocellular carcinoma [J]. J Nucl Med, 2008, 49(12): 1912-21.
[15] TSUCHIDA T, TAKEUCHI H, OKAZAWA H, et al. Grading of brain glioma with 1-11C-acetate PET: comparison with 18F-FDG PET [J]. Nucl Med Biol, 2008, 35(2): 171-6.
[16] SCHUG Z T, VANDE VOORDE J, GOTTLIEB E. The metabolic fate of acetate in cancer [J]. Nat Rev Cancer, 2016, 16(11): 708-17.
[17] AYALA A, MUÑOZ M F, ARGÜELLES S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal [J]. Oxid Med Cell Longev, 2014, doi: 10.1155/2014/360438.
[18] MURTHY D, ATTRI K S, SHUKLA S K, et al. Cancer-associated fibroblast-derived acetate promotes pancreatic cancer development by altering polyamine metabolism via the ACSS2-SP1-SAT1 axis [J]. Nat Cell Biol, 2024, 26(4): 613-27.
[19] DE VISSER K E, JOYCE J A. The evolving tumor microenvironment from cancer initiation to metastatic outgrowth [J]. Cancer Cell, 2023, 41(3): 374-403.
[20] ELIA I, HAIGIS M C. Metabolites and the tumour microenvironment: from cellular mechanisms to systemic metabolism [J]. Nat Metab, 2021, 3(1): 21-32.
[21] ROBINSON A, HAN C Z, GLASS C K, et al. Monocyte regulation in homeostasis and malignancy [J]. Trends Immunol, 2021, 42(2): 104-19.
[22] LIU D, LU Q, WANG X, et al. LSECtin on tumor-associated macrophages enhances breast cancer stemness via interaction with its receptor BTN3A3 [J]. Cell Res, 2019, 29(5): 365-78.
[23] WEI C, YANG C G, WANG S Y, et al. Crosstalk between cancer cells and tumor associated macrophages is required for mesenchymal circulating tumor cell-mediated colorectal cancer metastasis [J]. Mol Cancer, 2019, doi: 10.1186/s12943-019-0976-4.
[24] ZHU X D, ZHANG J B, ZHUANG P Y, et al. High expression of macrophage colony-stimulating factor in peritumoral liver tissue is associated with poor survival after curative resection of hepatocellular carcinoma [J]. J Clin Oncol, 2008, 26(16): 2707-16.
[25] CHRISTOFIDES A, STRAUSS L, YEO A, et al. The complex role of tumor-infiltrating macrophages [J]. Nat Immunol, 2022, 23(8): 1148-56.
[26] MEHLA K, SINGH P K. Metabolic regulation of macrophage polarization in cancer [J]. Trends Cancer, 2019, 5(12): 822-34.
[27] ZHANG X, JI L L, LI M O. Control of tumor-associated macrophage responses by nutrient acquisition and metabolism [J]. Immunity, 2023, 56(1): 14-31.
[28] SHEN L, WANG S H, GAO C, et al. Tumour-associated macrophages serve as an acetate reservoir to drive hepatocellular carcinoma metastasis [J]. Nat Metab, 2025, doi: 10.1038/s42255-025-01393-9.
[29] ZAKHARI S. Overview: how is alcohol metabolized by the body [J]? Alcohol Res Health, 2006, 29(4): 245-54.
[30] AYALA A, MUNOZ M F, ARGUELLES S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal [J]. Oxid Med Cell Longev, 2014, 2014: 360438.
[31] CHEN C H, SUN L, MOCHLY-ROSEN D. Mitochondrial aldehyde dehydrogenase and cardiac diseases [J]. Cardiovasc Res, 2010, 88(1): 51-7.
[32] SU P, WANG Q, BI E G, et al. Enhanced lipid accumulation and metabolism are required for the differentiation and activation of tumor-associated macrophages [J]. Cancer Res, 2020, 80(7): 1438-50.
[33] MASETTI M, CARRIERO R, PORTALE F, et al. Lipid-loaded tumor-associated macrophages sustain tumor growth and invasiveness in prostate cancer [J]. J Exp Med, 2021, 219(2): e20210564.
[34] ISSEROFF R R, ZIBOH V A, CHAPKIN R S, et al. Conversion of linoleic-acid into arachidonic-acid by cultured murine and human keratinocytes [J]. J Lipid Res, 1987, 28(11): 1342-9.
[35] SALEM N, PAWLOSKY R, WEGHER B, et al. In vivo conversion of linoleic acid to arachidonic acid in human adults [J]. Prostag Leukotr Ess, 1999, 60(5/6): 407-10.
[36] DOLL S, PRONETH B, TYURINA Y Y, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition [J]. Nat Chem Biol, 2017, 13(1): 91-8.
[37] KAGAN V E, MAO G, QU F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis [J]. Nat Chem Biol, 2017, 13(1): 81-90.




 中文版
中文版 英文版
英文版