领域前沿·中国
新型亚细胞结构血红蛋白小体增强软骨细胞的缺氧耐受
张波1 孙强1,2,3*
(1细胞工程研究室, 生物工程研究所, 军事医学研究院, 北京 100071; 2 细胞死亡机制创新单元(2021RU008),中国医学科学院, 北京 100071; 3南湖实验室, 嘉兴 314002)
 | 孙强研究员, 博士生导师, 军事科学院军事医学研究院研究员、研究室主任, 中国医学科学院“细胞死亡机制”院外创新单元主任。中国细胞生物学学会细胞死亡分会常委, 中国细胞生物学学会–细胞工程与转基因生物分会委员; 中国抗癌协会肿瘤分子医学专业委员会委员; Cell Death Differ期刊执行编委。承担国家自然科学基金、重点研发计划等多项课题。以通讯作者身份在Nature、Cell Res、Cell Death Diffe、Adv Sci、Cell Discov、Cell Rep、Signal Transduct TargetTher、Nucleic Acids Res等国际专业顶级杂志发表SCI论文50余篇。 |
新型亚细胞结构血红蛋白小体增强软骨细胞的缺氧耐受
张波1 孙强1,2,3*
(1细胞工程研究室, 生物工程研究所, 军事医学研究院, 北京 100071; 2 细胞死亡机制创新单元(2021RU008),中国医学科学院, 北京 100071; 3南湖实验室, 嘉兴 314002)
【摘要】最近的研究显示, 作为氧气载体的血红蛋白在软骨细胞中大量产生, 并且可以通过液–液相分离(liquid-liquid phase separation, LLPS)的方式聚合成血红蛋白小体(hemoglobin body,hedy)这一全新的细胞结构。软骨细胞中血红蛋白的产生依赖于Klf1而不是传统的Hif1/2α途径。敲除软骨细胞中的血红蛋白会导致软骨生长板缺氧加剧以及软骨组织中心区域广泛的细胞死亡。这一工作揭示了软骨细胞耐受缺氧的新机制, 即hedy可作为氧气储备和应急供应结构促进软骨细胞的存活。
【关键词】血红蛋白小体; 软骨细胞; 血红蛋白; Klf1; 相分离
Hemoglobin Body as a Novel Subcellular Structure EnhancesChondrocyte Hypoxia Adaption
ZHANG Bo1, SUN Qiang1,2,3*
(1Laboratory of Cell Engineering, Institute of Biotechnology, Academy of Military Medical Science, Beijing 100071,China; 2Research Unit of Cell Death Mechanism (2021RU008), Chinese Academy of Medical Science,Beijing 100071, China; 3Nanhu Laboratory, Jiaxing 314002, China)
【Abstract】 Recent study indicates that massive amounts of hemoglobin, a known carrier of oxygen in erythrocytes, is produced in chondrocyte, where it can form a new structure-Hemoglobin body (Hedy) by liquid-liquidphase separation. The production of hemoglobin in chondrocytes turns out to be dependent on Klf1 rather than theclassical Hif1/2α pathway. Hemoglobin depletion leads to enhanced hypoxia that causes extensive cell death in thecenter of cartilaginous tissue. These results demonstrate uncover a heretofore unrecognized mechanism where by chondrocytes survive a hypoxic environment on hedy, an oxygen storage for emergency supply.
【Keywords】hedy; hypoxia; chondrocyte; hemoglobin; Klf1; phase separation
1 血红蛋白的既往研究和新发现
血红蛋白为异源四聚体结构[1], 作为循环中最重要的携氧蛋白, 以往研究中认为除α地贫等疾病导致的病理性血红蛋白包涵体如Heinz小体[2]外, 血红蛋白均以可溶性蛋白的形式存在于红细胞中, 随血液循环为全身的组织细胞提供氧气。血红蛋白在红细胞中的表达受到HIF-EPO的经典内分泌调控通路[3-4]及红细胞内多因子调控网络的调节[5-6], 且随着红细胞的发育有序表达。过去血红蛋白被认为只在红细胞中表达, 但新近研究发现软骨细胞在缺氧条件下也会产生大量血红蛋白, 在细胞质内形成无膜的血红蛋白小体(hemoglobin body, hedy), 而血红蛋白小体则通过自身的储氧能力, 增强了软骨细胞对于缺氧环境的适应能力, 从而保证了软骨组织在无血管和无血液供氧条件下的正常发育和存活。
2 软骨细胞中血红蛋白小体的发现及形成机制研究
通过组织切片, 研究者在人和小鼠的软骨细胞中观察到一种可以被伊红染料深着色的细胞结构 ,在电镜观察中 , 此结构形态与红细胞极为类似 [7]。进一步通过质谱分析和免疫组织染色等技术发现 ,此结构含有大量的血红蛋白β亚基(hemoglobin betasubunit, HBB)和一定量的血红蛋白α亚基(hemoglobin alpha subunit, HBA)[7]。这些结果表明, 软骨细胞中存在大量的血红蛋白, 并形成了类似红细胞的结构。
为了进一步探索此结构的性质, 研究者对其进行了透射电子显微镜(transmission electron microscope, TEM)观察, 发现此结构是一种分布在软骨细胞胞质中的无膜小体而非红细胞, 提示血红蛋白可能通过相分离的方式形成了聚集体。与此相一致 ,研究者发现 HBB可以在多种细胞系的胞质中形成蛋白聚集物(图1A和图1B)。同时延时显微镜拍摄显示这些蛋白小体之间可以相互融合(图1C), 并且其荧光可以在光漂白后数分钟内快速恢复(图1D和图1E), 这表明蛋白小体的存在具有液相特征。此外,光电关联技术(correlative light and electron microscopy, CLEM)也确认了这些细胞质中的蛋白聚集物没有被膜包裹(图1F)。研究者通过序列分析确定了分别位于 HBB的氨基端和羧基末端的两个短的内在无序区(intrinsically disordered region, IDR), 能发生相分离的蛋白往往富含此类结构[8-9], 进一步实验发现通过突变其羧基端的IDR可以有效抑制聚集体的形成(图1G~图1I)。
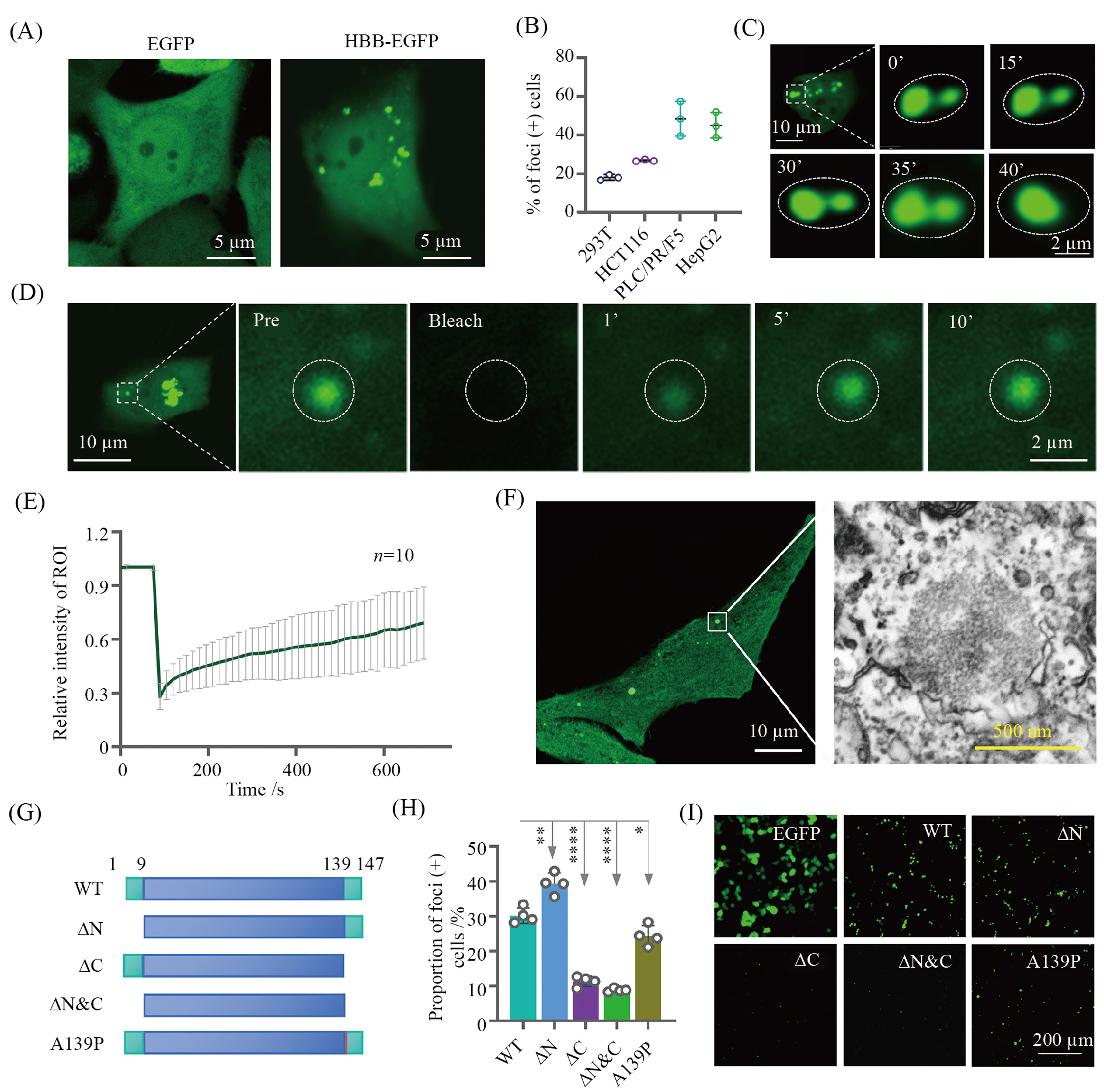
A: HepG2细胞中表达的EGFP和HBB-EGFP的荧光图像。白色箭头表示HBB-EGFP形成的聚集体。B: 不同细胞系中聚集体形成的量化结果。数据为3个视野的x_±s, 每个视野分析的细胞超过300个。C: 延时拍摄图像显示两个HBB-EGFP聚集体的融合过程。D: 延时拍摄图像显示HBBEGFP聚集体的光漂白恢复(fluorescence recovery after photobleach, FRAP)实验的结果。E: HBB-EGFP聚集体的FRAP数据的量化结果(平均值±SEM, n=10)。F: 通过光电关联(CLEM)获得的HBB-EGFP聚集体的荧光(左)和电子透射显微镜图像(右)。G: 示意图展示了具有单个及多个无序区域(绿色框)缺失或者A139P点突变(红色条)的HBB突变体。H、I: 通过过表达EGFP标记的HBB突变体的细胞内形成聚集体的阳性率统计图(H)和显微拍摄图(I)。
A: presentative images of EGFP and HBB-EGFP expressed in 293T cells. Arrow head indicates foci formed by HBB-EGFP. B: quantification of fociformation in different cell lines. Data are x_±s of 3 or more fields with more than 300 cells analyzed each. C: image sequence shows example of fusion oftwo HBB-EGFP foci. D: image sequence shows example of the FRAP experiment of HBB-EGFP foci. E: quantification of FRAP data (means ± SEM,n=10 experiments) for HBB-EGFP foci. F: fluorescence (left) and electron transmission microscopic images (right) of HBB-EGFP condensate by correlative light and electron microscopy (CLEM). G: schematic demonstration of HBB mutants with truncations in single or combined disorder motifs(green boxes) (∆N, ΔC, ΔN & ΔC), or with a point mutation of A139P (red bar). H,I: quantification (H) and representative images (I) of foci formationof the indicated HBB-EGFP mutants in 293T cells.
图1 相分离促进了血红蛋白小体的形成(根据参考文献[7]修改)
Fig.1 Phase separation promotes hedy formation (modified from reference [7])
为了进一步验证HBB的液液相分离特性, 研究者纯化了HBB-EGFP蛋白, 并且发现在特定的缓冲液中HBB-EGFP可以相互聚集形成液滴状分布, 且液滴之间可以相互融合(图2A)。进而研究者通过纯化无标记的 HBB进行体外实验得到了一致性的结果, 从而排除了EGFP对于蛋白液液相分离特性的影响, 同时发现只有在同时满足较高的蛋白浓度(大于250 ng/μL)和一定的离子浓度(0~150 mmol/L)的条件下才会形成明显的HBB液滴(图2B)。进一步实验发现在没有 HBB的情况下 , HBA不能单独形成液滴 (图 2C), 而且 HBB液滴之间也可以相互融合(图2D)。在体外, 相应的IDR区域突变同样可以有效抑制HBB液滴的形成, 与细胞内结果一致(图2E和图2F)。综合以上结果, 研究者发现血红蛋白具有液液相分离的特性 , 这促进了血红蛋白小体的形成。
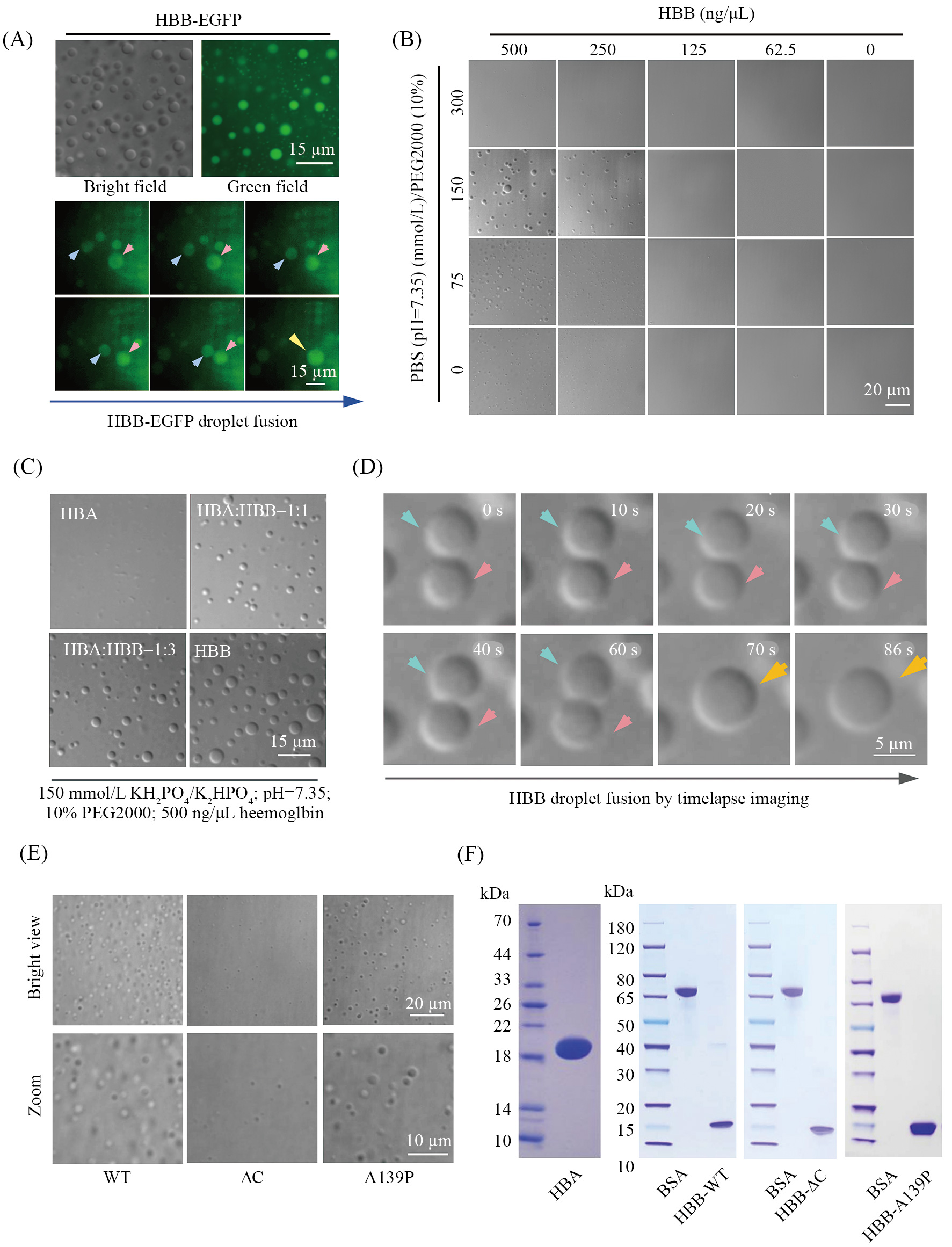
A: 纯化后的HBB-EGFP蛋白在相应缓冲液(150 mmol/L KH2PO4/K2HPO4; pH=7.35; 10% PEG2000; 蛋白浓度为1 μg/uL)中的形成的荧光液滴和液滴融合过程的延时拍摄图像。红色和白色箭头表示融合前的两个液滴, 黄色箭头表示融合后的液滴。B: 不同蛋白浓度和缓冲液浓度条件下HBB形成的液滴显微拍摄图。C: HBB和HBA通过不同比例进行混合后液滴形成的显微拍摄图。D: 延时拍摄图像显示HBB液滴之间相互融合的过程。E: HBB及其IDR突变体在缓冲液中形成液滴的对比图。F: HBB, HBA及其突变体的蛋白纯化后的SDS-PAGE电泳鉴定结果。
A: liquid phase separation of HBB-EGFP (upper panel) in LLPS buffer (150 mmol/L KH2PO4/K2HPO4; pH 7.35; PEG2000 10% (w/v); HBB-EGFP 1 μg/μL) andtimelapse imaging of HBB-EGFP droplet fusion (lower panel), white arrows and red arrows indicate droplets before fusion, yellow arrow indicates fused droplet.B: droplet formation of the purified untagged HBB in different conditions. C: droplet formation of the purified untagged HBA, HBB and the mixture ofthem in the different proportion in phase separation buffer. D: timelapse imaging of the purified untagged HBB droplet fusion. E: droplet formation ofthe purified HBB and its IDR mutants in phase separation buffer. F: coomassie brilliant blue stained gels of the purified HBA, HBB and HBB mutants.
图2 血红蛋白的体外液液相分离验证(根据参考文献[7]修改)
Fig.2 Phase separation of hemoglobin in vitro (modified from reference [7])
3 乏氧对于血红蛋白的调节依赖于Klf1而非Hif1/2
软骨组织为无血管组织 , 因其缺乏血液供应 ,氧气只能通过体液扩散进入软骨组织, 软骨细胞长期处于乏氧环境中。而乏氧则是公认的血红蛋白表达的诱导因素[10-12], 研究者通过对分离得到的软骨组织和细胞进行乏氧处理发现乏氧可以有效地诱导血红蛋白的表达。但是在敲除小鼠软骨细胞中的Hif1/2后, 血红蛋白的表达未有明显的变化, 这说明血红蛋白的表达不依赖于缺氧激活的HIF信号调节。因此, 研究者进一步对于红细胞及软骨细胞发育过程中发挥重要作用的分子[13-15]在乏氧处理后的表达变化进行检测, 发现只有Klf1的转录水平在乏氧处理后显著上调。Klf1作为转录因子在珠蛋白亚型转换中发挥着重要作用, 有研究发现其确实可以导致小鼠的β-地中海贫血[15-16]。在小鼠软骨细胞中特异性敲除klf1后, 血红蛋白的表达被显著抑制, 并且chip实验证明, KLF1蛋白直接结合血红蛋白的增强子和转录调控区域, 表明乏氧依赖于klf1调节血红蛋白的表达。
最近发表于Science杂志上的一项研究阐明了一种不依赖于Hif1基因的乏氧响应机制, 缺氧介导的去甲基化酶KDM5A水平下降通过提高基因区域的H3K4me3水平造成Klf10的上调[17]。巧合的是, 生物信息学分析在Klf1基因中预测到了H3K4me3的修饰位点, 表明Klf1是乏氧通过Kdm5a进行修饰调控的潜在靶点。进一步实验发现敲低Kdm5a即使在常氧条件下也显著提高了Klf1的H3K4me3修饰水平,同时上调了Klf1的表达。
4 hedy作为储氧结构增强细胞缺氧耐受保证细胞存活
通过软骨细胞特异性敲除血红蛋白, 研究者发现血红蛋白的缺失会破坏hedy的形成, 造成软骨组织尤其是生长板中心区域的缺氧程度加剧, 同时使大量软骨细胞死亡 [7]。为了探究内源表达的血红蛋白与细胞供氧的关系, 研究者测定了小鼠软骨细胞和红细胞的氧离曲线, 发现野生型软骨细胞具有和红细胞相似的氧离曲线, 证明其本身具有结合和释放氧气的能力, 同时野生型软骨细胞具有更低的P50, 说明相较于红细胞, 软骨细胞对于氧气的亲和力更强, 相应地敲除血红蛋白后, 软骨细胞则失去了此项能力(图3A)。为了进一步证实hedy可以作为缺氧时的供氧结构, 研究者将hedy分离出来与对乏氧高度敏感的PC12细胞在密闭小室中共培养, 发现hedy可以显著降低PC12细胞中缺氧响应分子HIF1的转录水平(图3B~图3D)。进一步, 通过在软骨细胞系ATDC5中过表达血红蛋白, 发现在乏氧条件下内部存在hedy的细胞的胞核中HIF1信号强度显著低于周围细胞(图3E和图3F), 说明存在hedy的细胞更耐受缺氧。因此, 这些数据支持hedy作为局部储氧结构这一观点, 该结构通过提供细胞所需的氧气, 以维持软骨细胞在缺氧环境中的生存。

A: 红细胞(RBCs)、野生型(WT)和Hbb敲除(Hbb-cKO)的软骨细胞的氧离曲线。Hbb-cKO的软骨细胞的氧结合能力几乎丧失。B: 从共表达HBA-mCherry和HBB-EGFP的293T细胞中收集的血红蛋白小体的代表性图像(左图为低倍大视野, 右图为高倍放大视野)。C: 密闭小室中的共培养实验示意图, 其中缺氧反应性细胞在中心小皿中培养, 而RBC或血红蛋白小体放置在小皿之外, 整体密闭24 h以制造缺氧环境。D: 通过定量PCR检测上述密闭小室实验中不同条件下Hif1α的表达。E: ATDC5细胞中HIF-1α染色的代表性图像。HIF-1α标记为深粉红色, 细胞核标记为蓝色, HBA-mCh为红色, HBB-EGFP为绿色。白色虚线描绘的是细胞轮廓, 蓝色虚线描绘的是细胞核。F: ATDC5细胞核中HIF-1α信号的荧光强度定量分析结果。n=33个存在血红蛋白小体的细胞, 341个不存在血红蛋白小体的细胞。
A: oxygen dissociation curves of red blood cells (RBCs), wild-type (WT) and Hbb-cKO chondrocytes. The chondrocytes of Hbb-cKO displayed pooroxygen binding capability as indicated by fluctuated curve. B: representative images of RBC (right panel) and hemoglobin condensates collected from293T cells co-expressing HBA-mCherry and HBB-EGFP (left panel for low magnification view, right panel for zoomed view). C: schematic diagramfor the nest coculture experiment, where the hypoxia-responsive cells were cultured in the inner dish while the RBCs or the hemoglobin condensateswere placed in the outer dish that were sealed for 24 h to create a hypoxia condition. D: expression of Hif1α under the indicated conditions of nestcoculture as examined by quantitative PCR. E: representative images for HIF-1α staining in ATDC5 cells. HIF-1α in deep pink, nuclei in blue, HBAmCh in red, HBB-EGFP in green. White dashed lines indicate outlines of foci positive cells, blue dashed lines indicate nulei of foci positive cells. F:quantification of the nuclear HIF-1α intensities in ATDC5 cells. n=33 for foci positive cells, 341 for foci negative cells.
图3 血红蛋白小体的供氧功能验证(根据参考文献[7]修改)
Fig.3 Oxygen supply function of hemoglobin body (modified from reference [7])
5 总结与展望
在既往研究中 , 血红蛋白在红细胞之外的组织细胞(包括血管内皮细胞[18]、气道上皮细胞[19]、系膜细胞[20]、神经元和神经胶质细胞[8]等)中表达偶有报道。但是大部分研究对于红细胞外血红蛋白的生物学功能的探究都基于推断 , 缺乏确凿的体内证据, 对于其调控机制更是缺乏深入研究。本研究通过体外生化实验和体内遗传修饰模型 , 发现并验证了血红蛋白小体作为储氧结构提供应急氧气供应从而保证细胞存活和软骨的正常发育, 与以上发现一致的是, 地中海贫血综合征患者常见关节疼痛 [21], 软骨相关疾病的患者中也多见低血红蛋白症状 , 如类风湿性关节炎 (rheumatoidarthritis, RA, 30%~70%)[22-23]和软骨发育不全 (约73%)[24]。此外, 血红蛋白较低的RA患者往往存在更严重的关节病变 [25], 而且关节症状可以在贫血纠正后得到缓解 [26]。这提示软骨细胞中的血红蛋白可能在疾病过程中发挥着重要作用。
本研究首次揭示了血红蛋白在正常组织中发挥的重要生物学功能 , 而且发现了血红蛋白独立于 HIF之外的表达调控新机制。同时在本研究中,研究者发现了血红蛋白组成的新型细胞结构—血红蛋白小体(hedy), 这是除病理性血红蛋白聚集形成包涵体[2]之外, 首次发现的细胞内具有生理性功能的血红蛋白聚集结构。血红蛋白的体外研究发现 , 血红蛋白多聚体往往存在着更高的氧气亲和力[27-28], 这与本文的研究结果相一致, 也说明血红蛋白的存在形式和结构可以影响血红蛋白的功能特性。而且通过详尽的实验, 研究者证明了血红蛋白液液相分离特性有助于 hedy的形成 , 同时发现了 IDR区域对于血红蛋白液液相分离的调控作用, 这说明血红蛋白聚集和小体形成是可控的, 为通过控制血红蛋白的聚集对体内部分生理或者病理过程实现调控这一构想提供了可能性。
参考文献 (References)
[1] PERUTZ M F. X-ray analysis of hemoglobin [J]. Science, 1963,140(3569): 863-9.
[2] EDWARDS C M, BELFORD C J. Characterization of Heinz bodies in unstable haemoglobin haemolytic anaemia [J]. Nature,1972, 240(5377): 150-2.
[3] SEMENZA G L, WANG G L. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation [J]. Mol Cell Biol, 1992, 12(12): 5447-54.
[4] LEE F S, PERCY M J. The HIF pathway and erythrocytosis [J].Annu Rev Pathol, 2011, 6: 165-92.
[5] STAMATOYANNOPOULOS G. Control of globin gene expression during development and erythroid differentiation [J]. ExpHematol, 2005, 33(3): 259-71.
[6] BANK A. Regulation of human fetal hemoglobin: new players,new complexities [J]. Blood, 2006, 107(2): 435-43.
[7] ZHANG F, ZHANG B, WANG Y, et al. An extra-erythrocyte roleof haemoglobin body in chondrocyte hypoxia adaption [J]. Nature, 2023, 622(7984): 834-41.
[8] BIAGIOLI M, PINTO M, CESSELLI D, et al. Unexpected expression of alpha- and beta-globin in mesencephalic dopaminergic neurons and glial cells [J]. Proc Natl Acad Sci USA, 2009,106(36): 15454-9.
[9] LI P L, BANJADE SUDEEP, CHENG H C, et al. Phase transitions in the assembly of multivalent signalling proteins [J]. Nature, 2012, 483(7389): 336-40.
[10] GUAN W, LI X, YANG Y Z, et al. Serum levels and significanceof HIF-1α and HIF-2α in healthy Tibetan and Han residents atdifferent altitudes [J]. Zhonghua Yi Xue Za Zhi, 2013, 93(38):3057-9.
[11] PEI S X. Relationship between hemoglobin concentration andred cell count of the immigrants in Tibet [J]. Zhonghua Nei KeZa Zhi, 1983, 22(12): 771-3.
[12] LI P B, NIE H J, LIU W, et al. A rat model of high altitude polycythemia rapidly established by hypobaric hypoxia exposure [J].Chinese Journal of Applied Physiology, 2014, 30(6): 526-31.
[13] YOKOMIZO TOMOMASA, HASEGAWA KAZUTERU, ISHITOBI HIROYUKI, et al. Runx1 is involved in primitive erythropoiesis in the mouse [J]. Blood, 2008, 111(8): 4075-80.
[14] PERKINS A C, SHARPE A H, ORKIN S H. Lethal betathalassaemia in mice lacking the erythroid CACCC-transcriptionfactor EKLF [J]. Nature, 1995, 375(6529): 318-22.
[15] PÁSZTY C, MOHANDAS N, STEVENS M E, et al. Lethalalpha-thalassaemia created by gene targeting in mice and its genetic rescue [J]. Nat Genet, 1995, 11(1): 33-9.
[16] CIAVATTA D J, RYAN T M, FARMER S C, et al. Mouse modelof human beta zero thalassemia: targeted deletion of the mousebeta maj- and beta min-globin genes in embryonic stem cells [J].Proc Natl Acad Sci USA, 1995, 92(20): 9259-63.
[17] BATIE M, FROST J, FROST M, et al. Hypoxia induces rapidchanges to histone methylation and reprograms chromatin [J].Science, 2019, 363(6432): 1222-6.
[18] STRAUB A C, LOHMAN A W, BILLAUD M, et al. Endothelialcell expression of haemoglobin alpha regulates nitric oxide signalling [J]. Nature, 2012, 491(7424): 473-7.
[19] NEWTON DANFORTH A, RAO K, MURALI KRISHNA, et al.Hemoglobin is expressed by alveolar epithelial cells [J]. J BiolChem, 2006, 281(9): 5668-76.
[20] NISHI HIROSHI, INAGI REIKO, KATO HIDEKI, et al. Hemoglobin is expressed by mesangial cells and reduces oxidant stress[J]. J Am Soc Nephrol, 2008, 19(8): 1500-8.
[21] VOGIATZI MARIA G, MACKLIN ERIC A, FUNG ELLEN B,et al. Bone disease in thalassemia: a frequent and still unresolvedproblem [J]. J Bone Miner Res, 2009, 24(3): 543-57.
[22] PEETERS H R, JONGEN-LAVRENCIC M, RAJA A N, et al.Course and characteristics of anaemia in patients with rheumatoid arthritis of recent onset [J]. Ann Rheum Dis, 1996, 55(3):162-8.
[23] WILSON A, YU H T, GOODNOUGH L T, et al. Prevalence andoutcomes of anemia in rheumatoid arthritis: a systematic reviewof the literature [J]. Am J Med, 2004, 116(Suppl 7A): 50S-7S.
[24] WILLIAMS M S, ETTINGER R S, HERMANNS P, et al. Thenatural history of severe anemia in cartilage-hair hypoplasia [J].Am J Med Genet A, 2005, 138(1): 35-40.
[25] TALUKDAR M, BARUI G, ADHIKARI A, et al. A study onassociation between common haematological parameters and disease activity in rheumatoid arthritis [J]. J Clin Diagn Res, 2017,doi: 10.7860/JCDR/2017/23524.9130.
[26] PEETERS H R, JONGEN-LAVRENCIC M, VREUGDENHIL G,et al. Effect of recombinant human erythropoietin on anaemia anddisease activity in patients with rheumatoid arthritis and anaemiaof chronic disease: a randomised placebo controlled double blind52 weeks clinical trial [J]. Ann Rheum Dis, 1996, 55(10): 739-44.
[27] MULLER C R, COURELLI V, WALSER C, et al. Polymerizedhuman hemoglobin with low and high oxygen affinity in traumamodels [J]. Transl Res, 2023, 260: 83-92.
[28] DEVENUTO F. Modified hemoglobin solution as a resuscitationfluid [J]. Vox Sang, 1983, 44(3): 129-42.



 中文版
中文版 英文版
英文版