领域前沿·中国
R9AP为EBV感染上皮细胞和B淋巴细胞的共同受体
李燕 曾木圣*
(华南肿瘤学国家重点实验室, 广东省鼻咽癌诊断与治疗重点实验室, 中山大学肿瘤防治中心, 广州 510060)
| 曾木圣, 中山大学肿瘤防治中心副主任、副院长, “国际EB病毒及相关疾病研究协会”主席、中国抗癌协会肿瘤微环境专业委员会主委、广东省肿瘤免疫与疫苗工程技术研究中心主任及2024 Gordon Research Conference鼻咽癌国际会议主席。入选国家高层次人才、“南粤百杰”和第九届国家卫生健康突出贡献中青年专家等。主持国家杰出青年科学基金、国家重点研发计划(2项)及多项国家自然科学基金重点项目。以通信(含共同通信)作者身份在Nature、Nat Microbiol(2篇)、Cell Host Microbe、Cancer Cell、Cell Res(2篇)等国内外著名期刊发表论文116篇;论文WOS总引用超1.5万次。以第一完成人获国家自然科学奖二等奖(2023)、教育部自然科学奖一等奖(2022)以及广东省自然科学奖一等奖(2018、2023)。 |
R9AP为EBV感染上皮细胞和B淋巴细胞的共同受体
李燕 曾木圣*
(华南肿瘤学国家重点实验室, 广东省鼻咽癌诊断与治疗重点实验室, 中山大学肿瘤防治中心, 广州 510060)
【摘要】
EB病毒(Epstein-Barr virus, EBV)感染全球超过90%以上的人群, 与多种疾病相关, 包括: 传染性单核细胞增多症、多种自身免疫性疾病及恶性肿瘤。既往的研究发现, EBV利用不同的糖蛋白-受体相互作用来感染两大主要宿主细胞: 上皮细胞和B淋巴细胞。然而, gH/gL和gB糖蛋白对病毒侵入这两种细胞类型均至关重要。值得注意的是, 针对gH/gL的特异性抗体AMMO1能够有效抑制EBV对上皮细胞和B淋巴细胞的感染, 是否存在可同时介导EBV进入这两种宿主细胞的共同受体一直未知。针对此问题, 该团队利用EBV高效感染模型, 通过文库筛选发现R9AP(RGS9 anchor protein)在EBV进入上皮细胞和B淋巴细胞中均为必需。进一步研究表明, 在上皮细胞中R9AP协同EphA2(ephrin receptor A2)与EBV糖蛋白gH/gL相互作用, 在B淋巴细胞中R9AP协同HLA class II与EBV糖蛋白gp42/gH/gL相互作用, 介导病毒与宿主细胞的膜融合过程。此外, 研究还发现R9AP衍生短肽及单克隆抗体可显著抑制EBV感染, 提示R9AP可作为EBV的潜在预防和疫苗靶点。
【关键词】EBV; R9AP; 上皮细胞; B淋巴细胞; 受体
R9AP is a Common Receptor for EBV Infection in Epithelial Cells and B Lymphocytes
LI Yan, ZENG Musheng*
(State Key Laboratory of Oncology in South China, Guangdong Key Laboratory of Nasopharyngeal Carcinoma Diagnosis and Therapy, Sun Yat-sen University Cancer Center, Guangzhou 510060, China)
【Abstract】EBV (Epstein-Barr virus) infects over 90% of the global population and is associated with various diseases, including infectious mononucleosis, multiple autoimmune disorders, and malignant tumors. Previous studies have demonstrated that EBV employs distinct glycoprotein-receptor combinations to infect its two major host cell types: epithelial cells and B lymphocytes. Nevertheless, the glycoproteins gH/gL and gB are essential for viral entry into both cell types. Notably, the gH/gL-specific antibody AMMO1 can effectively inhibit EBV infection in both epithelial cells and B lymphocytes. Whether a common receptor exists that mediates EBV entry into both cell types has remained unknown. To address this question, the research team employed a highly efficient EBV infection model and, through library screening, identified R9AP (RGS9 anchor protein) as essential for EBV entry into both epithelial cells and B lymphocytes. Further studies revealed that in epithelial cells, R9AP cooperates with EphA2 (ephrin receptor A2) to interact with the EBV glycoprotein gH/gL, while in B lymphocytes, R9AP cooperates with HLA class II to interact with the EBV glycoprotein complex gp42/gH/gL, thereby mediating the membrane fusion process between the virus and host cells. Additionally, the study found that R9AP-derived peptides and monoclonal antibodies can significantly inhibit EBV infection, suggesting their potential as targets for EBV prevention and vaccine development.
【Keywords】EBV; R9AP; epithelial cells; B lymphocytes; receptor
1 EBV与宿主细胞的互动
EB病毒(Epstein-Barr virus, EBV)属于γ-疱疹病毒, 感染全球超过90%以上的人群。EBV感染与多种疾病, 包括传染性单核细胞增多症、多发性硬化症、自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮)以及多种肿瘤(如鼻咽癌、EBV相关性胃癌、NK/T淋巴瘤、霍奇金淋巴瘤及伯基特淋巴瘤)发生密切相关。EBV主要通过唾液传播进入宿主细胞, 与宿主细胞的关系独特且复杂。它能够在宿主细胞内建立终身潜伏感染, 同时也能周期性地进入裂解性复制阶段产生新的病毒颗粒并传播。EBV主要在上皮细胞与B淋巴细胞这两类细胞之间交互感染, 完成“感染–潜伏–复制–传播”的生命周期, 并诱发各类EBV相关疾病[1]。
受体是病毒入侵细胞的关键门户, 也是阻断感染的核心靶点。既往研究发现, EBV可利用不同的受体感染上皮细胞及B淋巴细胞。当EBV感染B淋巴细胞时, EBV首先利用病毒糖蛋白gp350与B淋巴细胞表面补体受体CR2或CD35相互作用, 使病毒结合到细胞表面, 进一步通过EBV糖蛋白gp42与B淋巴细胞表面HLA-II相互作用, 引发EBV糖蛋白gH/gL及gB介导的融合, 使得病毒与细胞融合从而进入B淋巴细胞。然而CR2及CD35在上皮细胞中几乎不表达, HLA-II在上皮细胞中不表达或低表达。EBV感染上皮细胞也不需要gp350及gp42糖蛋白, 甚至当EBV表面携带较多gp42糖蛋白时反而可抑制EBV感染上皮细胞[2]。我们研究团队长期深耕于EBV感染上皮细胞机制研究, 此前已发现多个EBV感染上皮细胞的关键受体, 包括介导黏附的NMHC-IIA、介导内化的NRP1及触发膜融合的EphA2[3-5]。鉴于gH/gL及gB糖蛋白为EBV感染这两类细胞所必需,是否存在感染这两类细胞的共同受体仍为未知。接下来我们将以揭示R9AP为EBV感染上皮细胞和B淋巴细胞的共同受体为例[6], 介绍EBV感染机制研究新范式。
2 R9AP的筛选与介导EBV感染的功能鉴定
EBV感染普通培养条件下的鼻咽上皮细胞效率极低, 为EBV感染上皮细胞机制研究的困境。我们课题组之前报道, 当Bmi1永生化的鼻咽上皮细胞在三维培养条件下形成球样生长细胞(sphere-like cells, SLCs)时, 相比于普通条件下培养的平面细胞(monolayer cells, MLCs), SLCs能够更高效率地被EBV感染[3]。因此, 我们推测相对于不易被EBV感染的MLCs, 在SLCs中某些促进EBV感染的关键因子被上调表达。我们利用表达谱芯片进行分析, 发现相对于MLCs, 有多个膜蛋白相关基因在SLCs中上调表达(图1A)。针对这些上调表达的膜蛋白相关基因我们合成了siRNA文库进行筛选, 并对筛选结果进行了初步验证, 发现了在Bmi1永生化的鼻咽上皮细胞敲低R9AP可以显著降低EBV感染效率(图1B),且R9AP可以同时在上皮细胞和B淋巴细胞中表达(图1C)。而在293T细胞中过表达R9AP可以明显提高EBV感染效率(图1D)。我们在多株上皮细胞和B淋巴细胞中也进一步验证了R9AP介导EBV感染的重要功能。
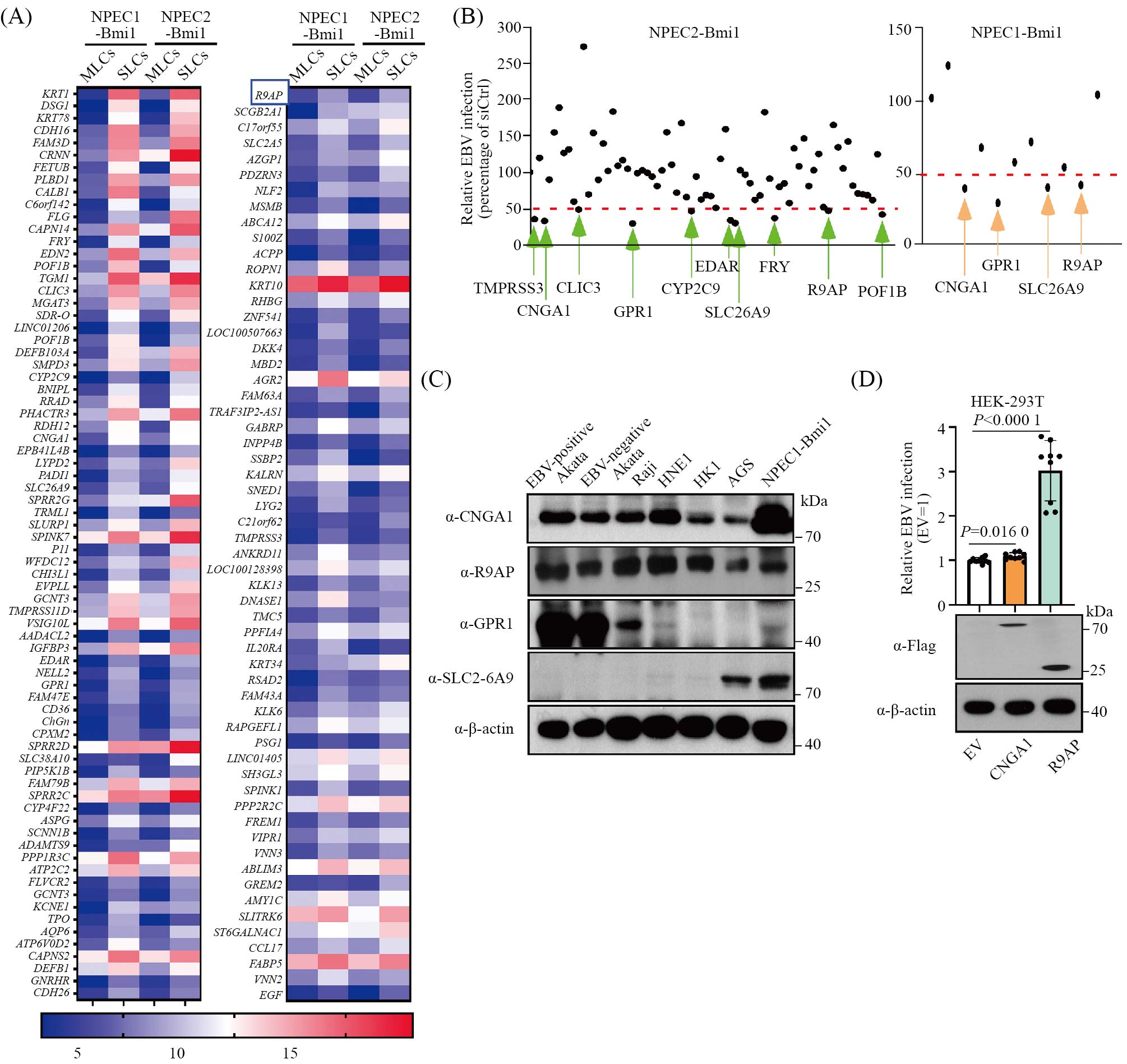
A: 表达谱芯片分析MLCs与SLCs之间膜蛋白相关基因的表达差异。B: siRNA文库转入SLCs细胞后对EBV感染效率的影响。C: CNGA1、R9AP、GPR1及SLC26A9在上皮细胞和B淋巴细胞中的蛋白表达。D: CNGA1及R9AP在293T细胞中过表达后对EBV感染效率的影响。
A: microarray analyzing of genes in SLCs compared to MLCs of NPEC1-Bmi1 and NPEC2-Bmi1 cells. B: EBV infection efficiency of SLCs cells after transfecting with siRNA library. C: the endogenous protein expression of CNGA1, R9AP, GPR1 and SLC26A9 in epithelial cells and B lymphocytes. D: EBV infection efficiencies of HEK-293T cells after being transfected with CNGA1 or R9AP.
图1 筛选发现R9AP为EBV感染上皮细胞的关键分子(根据参考文献[6]修改)
Fig.1 Screening revealed that R9AP is a key molecule for EBV infection of epithelial cells (modified from reference [6])
3 R9AP的构象反转
既往研究认为R9AP的N-端被认为表达在细胞胞质内, 介导RGS9定位在胞膜[7]。我们分别利用网站http://www.cbs.dtu.dk/services/TMHMM/及http://www.ebi.ac.uk/interpro/sequencesearch进行预测, 结果均显示R9AP的N定位在细胞膜胞外。
进一步我们利用实验分析R9AP的细胞定位情况。我们分别在全长野生型R9APFL与缺失C-端及跨膜区的R9AP1-210质粒N-端加上Flag标签, 再在Flag与R9APFL或R9AP1-210起始密码子之间加上PSP酶切位点, 即分别为Flag-psp-R9APFL与Flag-psp-R9AP1-210。Flag-psp-R9AP1-210缺失了跨膜区, 不能定位到细胞膜,只表达在胞质, 在细胞外加入PSP 酶后, Flag标签将不被PSP酶切断。Flag-psp-R9APFL则包括了R9AP全长, 若N-端表达在细胞外, 则在细胞外加入PSP酶后,Flag标签将被PSP酶切断(图2A)。我们在细胞中分别瞬转Flag-psp-R9APFL与Flag-psp-R9AP1-210质粒, 24 h后, 将细胞固定, 在细胞外加入PSP酶, 酶切后收集蛋白进行Western blot分析。结果显示相对于Flag-psp-R9AP1-210, Flag-psp-R9APFL的Flag标签水平显著减少(图2B)。进一步我们利用免疫荧光的方法分析R9AP的N-端定位, 我们在R9AP1-210及 R9APFL的N-端加上Myc标签, 即分别为Myc-R9AP1-210与Myc-R9APFL。在细胞中分别瞬转Myc-R9AP1-210与Myc-R9APFL后,24 h后将细胞固定进行免疫荧光实验。在未用 TritonX-100破膜处理的细胞中, 利用Myc抗体只能在过表达了Myc-R9APFL的细胞中检测到Myc标签; 而在用Triton X-100破膜处理的细胞中, Myc抗体在过表达了Myc-R9APFL与Myc-R9AP1-210的细胞中均能检测到Myc标签(图2C)。这些结果均表明R9AP的N-端可定位在细胞膜外。
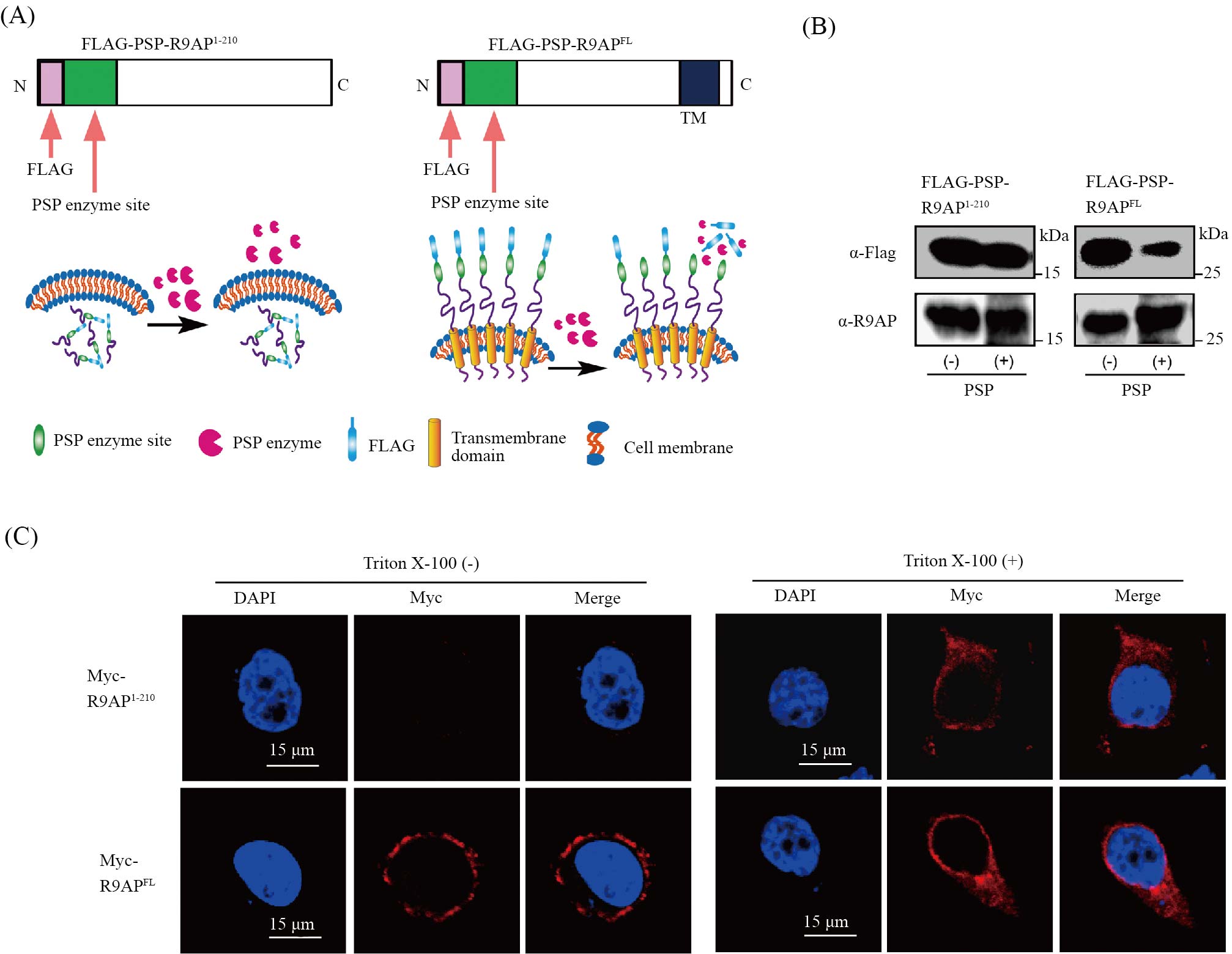
A: PSP酶切实验示意图。B: PSP酶切实验的Western blot结果。C: 免疫荧光显示Myc-R9APFL与Myc-R9AP1-210在Triton X-100未处理与处理后在细胞中的表达情况。
A: the schematic of PSP (PreScission protease) cleavage. B: the Western blot result of PSP cleavage assay. C: immunostaining result of cells transfected with Myc-R9AP1-210 or Myc-R9APFL expression plasmid and treated with or without Triton X-100.
图2 R9AP的N-端可定位在细胞膜外(根据参考文献[6]修改)
Fig.2 The N-terminus of R9AP could be localized outside the cell membrane (modified from reference [6])
4 R9AP与EBV糖蛋白gH/gL相互作用介导膜融合
EBV依赖囊膜表面糖蛋白与细胞表面受体相互作用而感染宿主细胞, gH/gL及gB糖蛋白为EBV同时感染上皮细胞和B淋巴细胞所必需。免疫共沉淀结果显示R9AP与gH/gL相互作用而不与gB相互作用(图3A和图3B)。囊膜病毒感染细胞是一个多步骤过程。通常病毒通过囊膜表面分子与细胞表面受体相互作用, 使病毒黏附到细胞表面。随后病毒发生构象改变、激活细胞信号通路, 从而进入细胞。最终, 病毒囊膜发生融合从而释放病毒核酸[8-9]。我们的结果显示R9AP敲低或过表达对EBV结合无影响(图3C和图3D), 而对融合过程影响显著(图3E~图3G)。
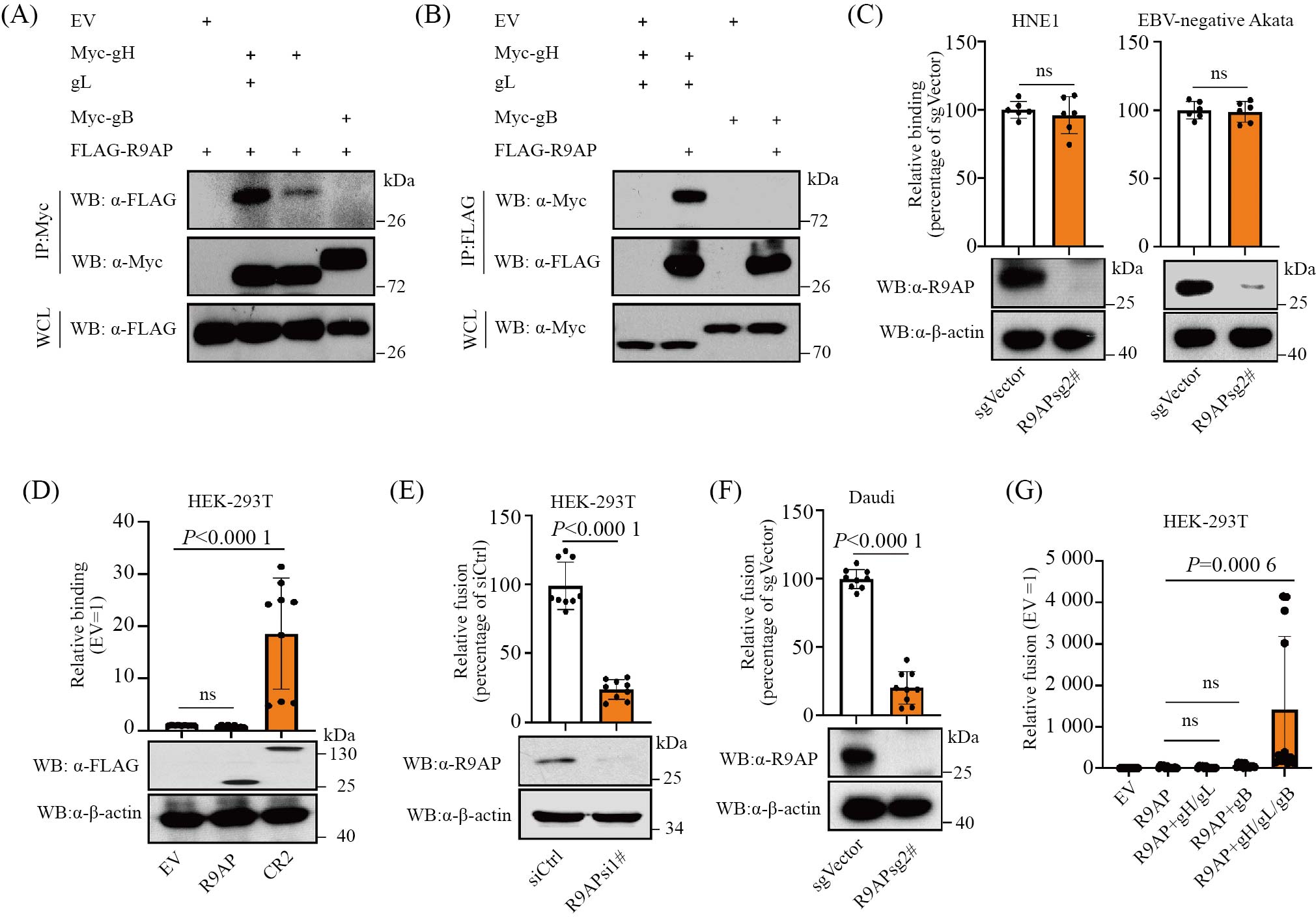
A、B: 免疫共沉淀实验检测R9AP与EBV糖蛋白gH/gL及gB的相互作用。C: 细胞中敲低R9AP后检测病毒的结合。D: 细胞中过表达R9AP后检测病毒的结合。E、F: 细胞中敲低R9AP后检测膜融合。G: 细胞中过表达R9AP后检测膜融合。ns: 无显著差别。
A,B: immunoprecipitation assay to detect the interaction between R9AP and EBV glycoproteins gH/gL or gB. C: EBV binding in R9AP downregulated cells. D: EBV binding in R9AP overexpressed cells. E,F: fusion assay in R9AP downregulated cells. G: fusion assay in R9AP overexpressed cells. ns: not significant.
图3 R9AP与gH/gL作用介导膜融合(根据参考文献[6]修改)
Fig.3 R9AP interacted with gH/gL to mediate membrane fusion (modified from reference [6])
5 R9AP衍生短肽及单克隆抗体阻断EBV感染
为了探究R9AP的临床转化价值, 我们筛选了R9AP相关短肽及单克隆抗体。R9AP 1—50氨基酸对其介导EBV感染至关重要, 针对该区域, 我们设计了一系列R9AP相关短肽, 结果表明只有R9AP衍生短肽可在上皮细胞及B淋巴细胞中有效阻断EBV感染(图4A和图4B)。同时, 我们也筛选了一系列靶向R9AP的单克隆抗体, 其中克隆号为5E9的抗R9AP单克隆抗体可在上皮细胞及B淋巴细胞中有效阻断EBV感染(图4C)。这些结果提示R9AP可作为抗EBV感染的潜在靶标。
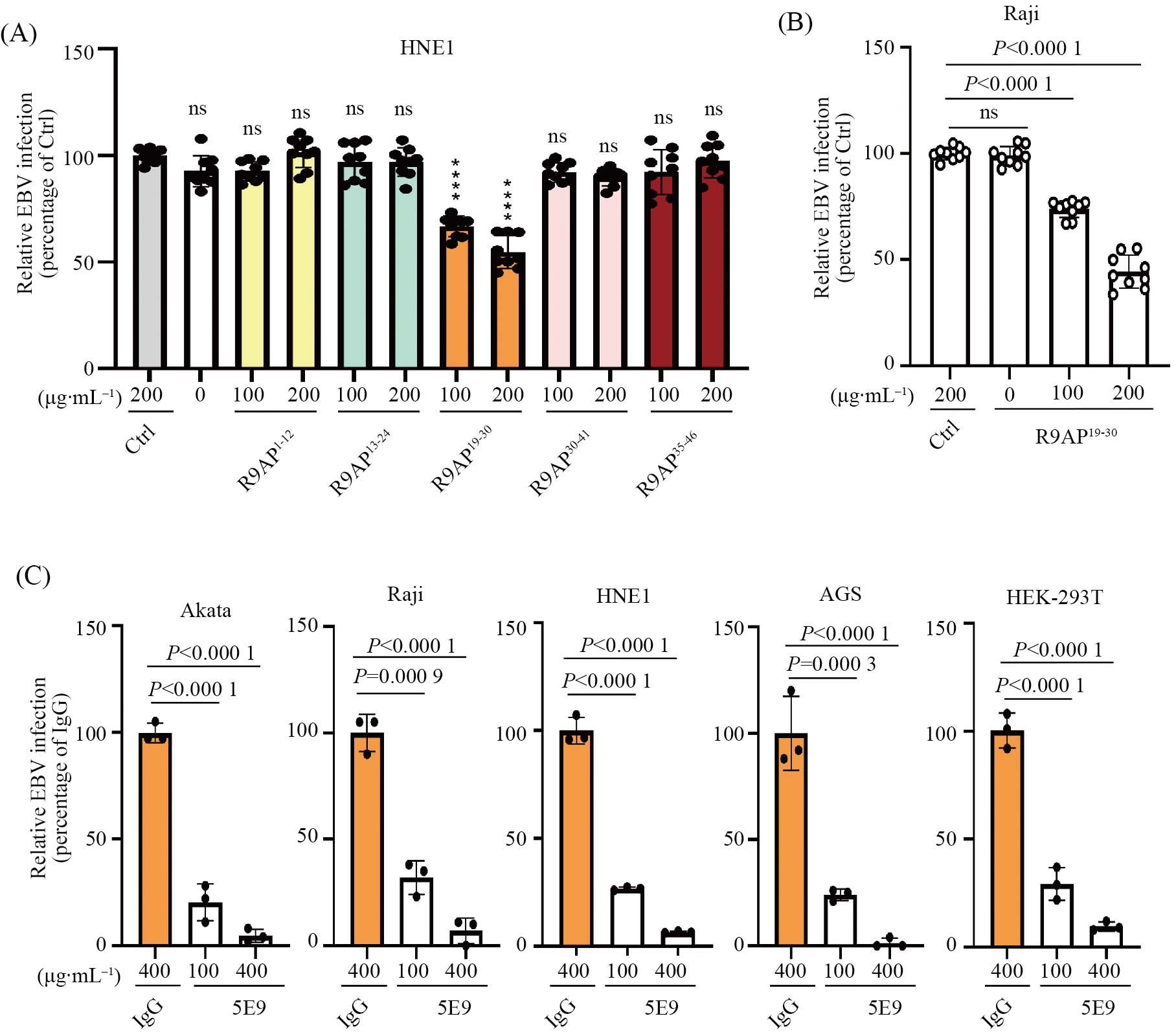
A: 在上皮细胞筛选可抑制EBV感染的R9AP短肽。B: R9AP19-30短肽在B淋巴细胞来源Raji细胞中抑制EBV感染。C: 抗R9AP单克隆抗体5E9可同时在B淋巴细胞及上皮细胞中抑制EBV感染。ns: 无显著差别。
A: screening for R9AP-derived short peptides that can inhibit EBV infection in epithelial cells. B: R9AP19-30 short peptides inhibit EBV infection in B lymphocyte-derived Raji cells. C: anti-R9AP monoclonal antibody 5E9 inhibited EBV infection in both B lymphocytes and epithelial cells. ns: not significant.
图4 阻断R9AP抑制EBV感染(根据参考文献[6]修改)
Fig.4 Blocking R9AP inhibited EBV infection (modified from reference [6])
6 EBV在上皮细胞和B淋巴细胞间交互感染的机制探索
既往研究发现源自上皮细胞的EBV表面富含gp42糖蛋白, 而源自B淋巴细胞的EBV表面缺乏gp42糖蛋白。上皮细胞来源的EBV较B淋巴细胞来源的EBV更容易感染B淋巴细胞, 而不易感染上皮细胞本身[10]。我们的研究结果提示B细胞来源的EBV利用其gH/gL糖蛋白直接结合上皮细胞受体R9AP和EphA2进行感染。相反, 上皮细胞来源的EBV因富含gH/gL/gp42三聚体, 其gp42糖蛋白会遮蔽gH/gL上的R9AP结合位点。因此, 病毒需先通过gp42结合B细胞上的gp42受体HLA-II, 从而释放R9AP结合位点, 才能最终完成感染(图5)。值得注意的是, 由于正常上皮细胞不表达或低表达HLA-II, 它们对上皮细胞来源的EBV不易感, 这解释了EBV交叉感染的关键谜题。
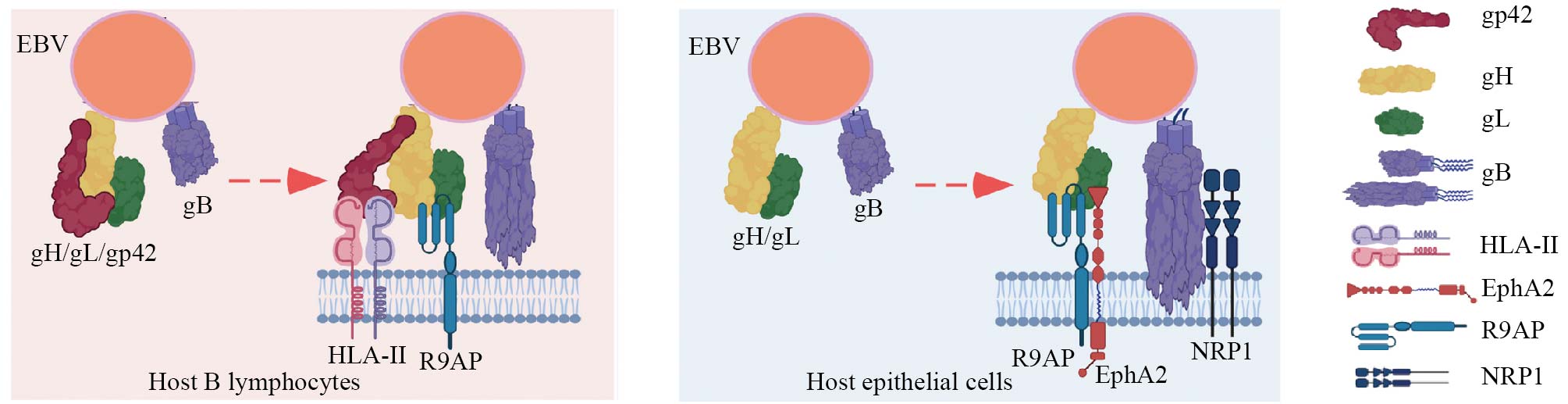
图5 R9AP在B淋巴细胞与上皮细胞介导EBV感染的示意图(根据参考文献[6]修改)
Fig.5 Schematic diagram of R9AP mediating EBV infection in B cells and epithelial cells (modified from reference [6])
7 总结与展望
本研究首次发现R9AP与EBV糖蛋白gH/gL相互作用, 在EBV进入上皮细胞及B淋巴细胞过程中均起关键作用, 为EBV感染主要宿主细胞的通用型受体,突破了“EBV感染B淋巴细胞与上皮细胞受体截然不同”的传统认知。本研究为EBV感染机制的研究提供了新范式, 区别于以往强调EBV感染上皮细胞与B淋巴细胞利用不同受体的观点, 首次强调了EBV在感染两类宿主细胞可利用相同的受体。R9AP为gH/gL的受体, 而gH/gL及gB均为EBV感染这两类宿主细胞所必需, 是否在这两类宿主细胞存在其他gH/gL或gB的共同受体仍待进一步的研究。
本研究不仅为后续开发高效、广谱抗EBV药物和疫苗提供了直接的分子靶标和坚实的病毒学基础, 同时也深化了我们对EBV如何进入宿主细胞的理解, 尤其是EBV如何在B淋巴细胞与上皮细胞之间交互感染。此外, 本研究还首次揭示了R9AP在细胞膜的双向定位能力, 拓展了对其生物学作用的理解。然而, 多项关键问题仍有待探索: (1) R9AP/HLA-II和R9AP/EphA2复合物的结构解析对于完善对病毒与宿主细胞膜融合过程的认识至关重要; (2) R9AP在细胞膜的双向定位这一突破性发现的分子机制尚不清楚; (3) 基于R9AP与gH/gL相互作用结构域的EBV疫苗开发仍需进一步的研究。
参考文献 (References)
[1] YOUNG L S, RICKISON A B. Epstein-Barr virus: 40 years on [J]. Nat Rev Cancer, 2004, 4(10): 757-68.
[2] HUTT-FLETCHER L M. Epstein-Barr virus entry [J]. J Virol, 2007, 81(15): 7825-32.
[3] XIONG D, DU Y, WANG H B, et al. Nonmuscle myosin heavy chain IIA mediates Epstein-Barr virus infection of nasopharyngeal epithelial cells [J]. Proc Natl Acad Sci USA, 2015, 112(35): 11036-41.
[4] WANG H B, ZHANG H, ZHANG J P, et al. Neuropilin 1 is an entry factor that promotes EBV infection of nasopharyngeal epithelial cells [J]. Nat Commun, 2015, 6: 6240.
[5] ZHANG H, LI Y, WANG H B, et al. Ephrin receptor A2 is an epithelial cell receptor for Epstein-Barr virus entry [J]. Nat Microbiol, 2018, 3(2): 1-8.
[6] LI Y, ZHANG H, SUN C, et al. R9AP is a common receptor for EBV infection in epithelial cells and B cells [J]. Nature, 2025, doi:10.1038/s41586-025-09166-w.
[7] HU G, WENSEL T G. R9AP, a membrane anchor for the photoreceptor GTPase accelerating protein, RGS9-1 [J]. Proc Natl Acad Sci USA, 2002, 99(15): 9755-60.
[8] MARSH M, HELENIUS A. Virus entry: open sesame [J]. Cell, 2006, 124(4): 729-40.
[9] EISENBERG R J, ATANASIU D, CAIRNS T M, et al. Herpes virus fusion and entry: a story with many characters [J]. Viruses, 2012, 4(5): 800-32.
[10] BORZA C M, HUTT-FLETCHER L M. Alternate replication in B cells and epithelial cells switches tropism of Epstein-Barr virus [J]. Nat Med, 2002, 8(6): 594-9.




 中文版
中文版 英文版
英文版