领域前沿·中国
基于胚胎补偿技术在猪体内再造人源中肾
王教伟 栗楠 戴祯 赖良学*
(中国科学院再生生物学重点实验室, 广东省干细胞与再生医学重点实验室,中国科学院广州生物医药与健康研究院, 中国科学院大学, 广州 510530)
 | 赖良学, 中国科学院广州生物医药与健康研究院研究员。1998年在美国密苏里大学从事博士后研究; 2002年任美国密苏里大学研究助理教授; 2007年起在中国科学院广州生物医药与健康研究院工作, 任研究员、博士生导师。实验室长期开展基因编辑人源化大动物模型培育与应用研究。以第一或通讯作者的身份在Science、Cell、Nat Biotechnol、Cell Stem Cell等国际期刊发表研究论文多篇。 |
基于胚胎补偿技术在猪体内再造人源中肾
王教伟 栗楠 戴祯 赖良学*
(中国科学院再生生物学重点实验室, 广东省干细胞与再生医学重点实验室,中国科学院广州生物医药与健康研究院, 中国科学院大学, 广州 510530)
【摘要】肾脏移植是针对终末期肾脏疾病的首选治疗手段。但供体肾源短缺严重限制了这一有效疗法的临床应用。基于胚胎补偿技术的器官异种体内再造策略已被视为解决器官短缺问题的理想方案。然而, 能否借助该策略在大动物体内获得可用于移植的人源肾脏尚未可知。本研究首先向人诱导多能干细胞中转入促增殖基因MYCN及抗凋亡基因BCL2, 随后利用先前开发的可用于高效获取人类早期胚胎样干细胞的培养体系4CL对其培养, 获得了可用于进行异种胚胎嵌合的理想人源供体细胞, 并针对该细胞的特性, 对胚胎补偿技术体系进行了全方位优化。同时, 该研究成功构建了中肾缺陷、后肾完全缺失的新型肾脏缺陷猪模型。依赖于上述研究基础, 本研究首次在异种大动物猪体内实现了人源中肾再造。经检测, 嵌合中肾内的人源细胞占比高达70%, 其参与构成的中肾小管占比可达58%。更为重要的是, 这些细胞会表达与肾脏发育相关的重要功能性基因,表明其能够分化成为具有肾脏发育功能的细胞类型, 具有支持后肾形成的潜能。该项研究是世界范围内首次成功实现的人源功能性实质器官异种体内再造, 为解决供体器官严重短缺问题开辟新方向。
【关键词】 胚胎补偿技术; 器官异种再造; 人多能干细胞; 肾脏缺陷猪模型
Generation of a Humanized Mesonephros in Pigs via Embryo Complementation
WANG Jiaowei, LI Nan, DAI Zhen, LAI Liangxue*
(CAS Key Laboratory of Regenerative Biology, Guangdong Provincial Key Laboratory of Stem Cell and Regenerative Medicine,Guangzhou Institutes of Biomedicine and Health, Chinese Academy of Sciences, Guangzhou 510530, China)
【Abstract】 Organ transplantation is the best way for treating end-stage kidney diseases, but is limited bythe shortage of donor organs. Generating human organs in large mammals through embryo complementation holdsgreat potential to solve it. However, it remains unknown whether it is feasible to grow human kidneys in largemammals through this approach. In this study, hiPSCs were transferred with proliferation-promoting gene MYCNand the anti-apoptotic gene BCL2 to enhance the competitiveness and survival ability of cells in pig embryos, andthen were induced into naïve state with a special medium (4CL), created an ideal donor cell type for chimeric integration. Besides, the embryo complementation technique was comprehensively optimized and a novel pig modelwith partial mesonephric-deficient and complete metanephros deficiency was generated. Based on above efforts,human mesonephros kidneys were grown inside nephric-deficient pigs. The proportion of human-derived cells inthe chimeric mesonephros reached up to 70%, and the proportion of the mesonephric tubules reach a maximum of58%. Importantly, these cells expressed functional markers for kidney development, indicating that human donorcells could differentiate into functional cells and hold potential for the formation of metanephros. For the first time,this study validates the feasibility of generating a humanized solid organ in organogenesis-disabled pigs, opening anew avenue to solve the shortage of human organs for transplantation.
【Keywords】embryo complementation technology; xenogeneic organogenesis; human pluripotent stemcells; nephric-defective pig model
1 基于胚胎补偿技术实现肾脏异种体内再造的研究背景
基于胚胎补偿技术的器官异种体内再造是再生医学领域的研究热点, 这一策略的基本思路是将患者自体来源的细胞诱导为具有多向分化潜能的人多能干细胞(human pluripotent stem cells, hPSCs),之后再将其注射到组织或器官缺陷的大动物胚胎中。伴随着胚胎的发育, 人源供体细胞会增殖、分化, 并对缺陷动物提供的空缺生态位进行富集补偿,进而可在器官缺陷大动物体内再造相应的功能性组织或器官[1-2]。大小鼠的相关研究已证明基于胚胎补偿技术实现肾脏异种体内再造的可行性[3]。但若要获得可用于人体移植的肾脏, 则最终需要在器官缺陷大动物模型中实现[4]。相较于其他大动物而言, 猪因其自身优势而被视为是用于人源器官异种体内再造的理想动物载体。一方面, 猪具有与人类相似的遗传背景、解剖结构、器官体积及免疫机制, 可为再造的人源器官提供理想的体内发育环境[5-6]。基于此, 再造的人源器官能够发育更加成熟, 功能也会更加完善。另一方面, 基因缺陷猪模型的构建技术已十分成熟, 应用基因编辑工具结合体细胞核移植技术可以高效地获得多基因突变的器官缺陷猪模型[7]。最近的两项基于猪的器官异种体内再造相关研究分别报道利用ETV2敲除的血管内皮缺陷猪模型, 以及MYF5/MYOD/MYF6三基因敲除的肌肉缺陷猪模型,成功实现了人源血管内皮组织及肌肉组织的异种体内再造[8-9], 为应用大动物获取人源肾脏奠定了重要的理论及技术基础。然而, 基于猪等大动物模型的实质器官异种体内再造尚未能实现。人干细胞在猪体内的异种嵌合还存在诸多问题有待解决, 例如: 由于物种差异、进化距离等原因, 大量的人源细胞将伴随着胚胎的发育出现无法增殖乃至凋亡的现象[10]; 分化潜能不足的人源供体细胞将无法在异种胚胎中支持如肾脏等具有更为复杂细胞类型的功能性实质器官的形成; 基于人源干细胞的胚胎补偿技术体系尚不成熟, 有待进一步优化; 对于发育过程复杂的器官, 单一基因缺陷不足以构建具有充足生态位空缺的器官缺陷猪模型[1]。因此, 基于多能干细胞结合胚胎补偿技术的实质器官异种体内再造仍然具有挑战性。
2 高分化潜能、强增殖及抗凋亡能力的人诱导多能干细胞(4CL/N/B)的建立
人多能干细胞是再生医学中的种子细胞, 其具有分化成为多种类型细胞的能力, 这种分化潜能也是实现器官异种体内再造的重要先决条件[1-11]。伴随着研究的不断深入, 研究人员发现在不同体外培养体系下获得的hPSCs会表现出不同的转录、表观遗传和代谢特征。而这些不同的分子表型特征也将决定hPSCs在异种动物中的分化潜能[12]。为了获得具有更高分化潜能的人源供体细胞, 我们首先利用前期获得的新型干细胞培养基4CL对DsRed荧光蛋白标记的人多能干细胞进行培养, 并通过单细胞RNA测序(single-cell RNA-sequencing, scRNA-seq), 将其与利用mTSeR1培养基, 以及多种已经报道可获得早期胚胎样细胞的培养基(包括基于NHSM的商业培养基RSeT培养基[13]、PXGL培养基[14]以及5iLA[15]培养基)培养获得的hPSCs进行比较。利用先前报道的人不同时期植入前胚胎scRNA-seq数据作为参照[16], 对4CL培养基培养获得的供体细胞所处细胞状态进行更为全面的分析。结果表明, 通过4CL培养基培养获得的细胞与植入前E5胚胎具有更为接近的转录组表达模式, 说明其可被定义为早期胚胎样的hPSCs(图1A和图1B)。多能性标志基因的表达情况是评估干细胞分化潜能的重要指标[1]。为了进一步评估利用不同培养基培养获得的供体细胞所具有的分化潜能, 我们也基于scRNA-seq数据对来源于不同培养体系获得的hPSCs进行了多种多能性相关基因表达情况分析。其中, 利用4CL培养基获得的早期胚胎样细胞具有更为完善的多能性基因表达谱, 说明其将具有更好的分化潜能(图1C)。
除了细胞多能性外, 供体细胞早期凋亡以及与宿主细胞的竞争也极大地阻碍了嵌合体的形成[17-19]。在前期研究中, 我们发现通过在hPSCs中过表达促增殖基因MYCN及抗凋亡基因BCL2, 有效地提高了人源供体细胞的竞争及抗凋亡能力, 并成功应用其在血管发育缺陷的小鼠体内再造人的造血细胞[20]。因此, 在本研究中, 我们也将包装有Tet-on诱导MYCN/BCL2基因表达系统以及嘌呤霉素抗性基因的慢病毒转染定点敲入DsRed基因的hPSCs。通过向转染后的细胞培养基中添加嘌呤霉素对细胞进行药物筛选, 从而获得阳性细胞。随后, 我们利用4CL培养基对阳性hPSCs进行培养, 进而获得了转入MYCN/BCL2基因的新型hPSCs, 我们将该细胞命名为4CL/N/B细胞[21]。经Dox诱导3天后, 4CL/N/B细胞中MYCN与BCL2均具有较高表达水平(图1D)。
为了检测过表达MYCN及BCL2是否会对细胞多能性产生影响, 我们对4CL/N/B细胞与4CL培养基诱导获得的hPSCs进行单细胞转录组测序。分析结果显示, 二者的多能性相关基因表达情况基本一致(图1E)。同时, 通过对二者的差异基因进行GO富集分析可发现, 表达量上调的差异基因主要与细胞周期、细胞分裂、核糖体生物合成、纺锤体组装、DNA复制及凋亡信号通路调节等生物过程相关(图1F)。此外, 基于scRNA-seq数据的细胞周期分析表明, 相较于4CL培养的hPSCs而言, 更多的4CL/N/B细胞处于G2/M期(图1G), 表明MYCN及BCL2的过表达能够通过加速细胞周期促进细胞增殖分裂, 这将有益于4CL/N/B细胞在异种胚胎中的生存能力。
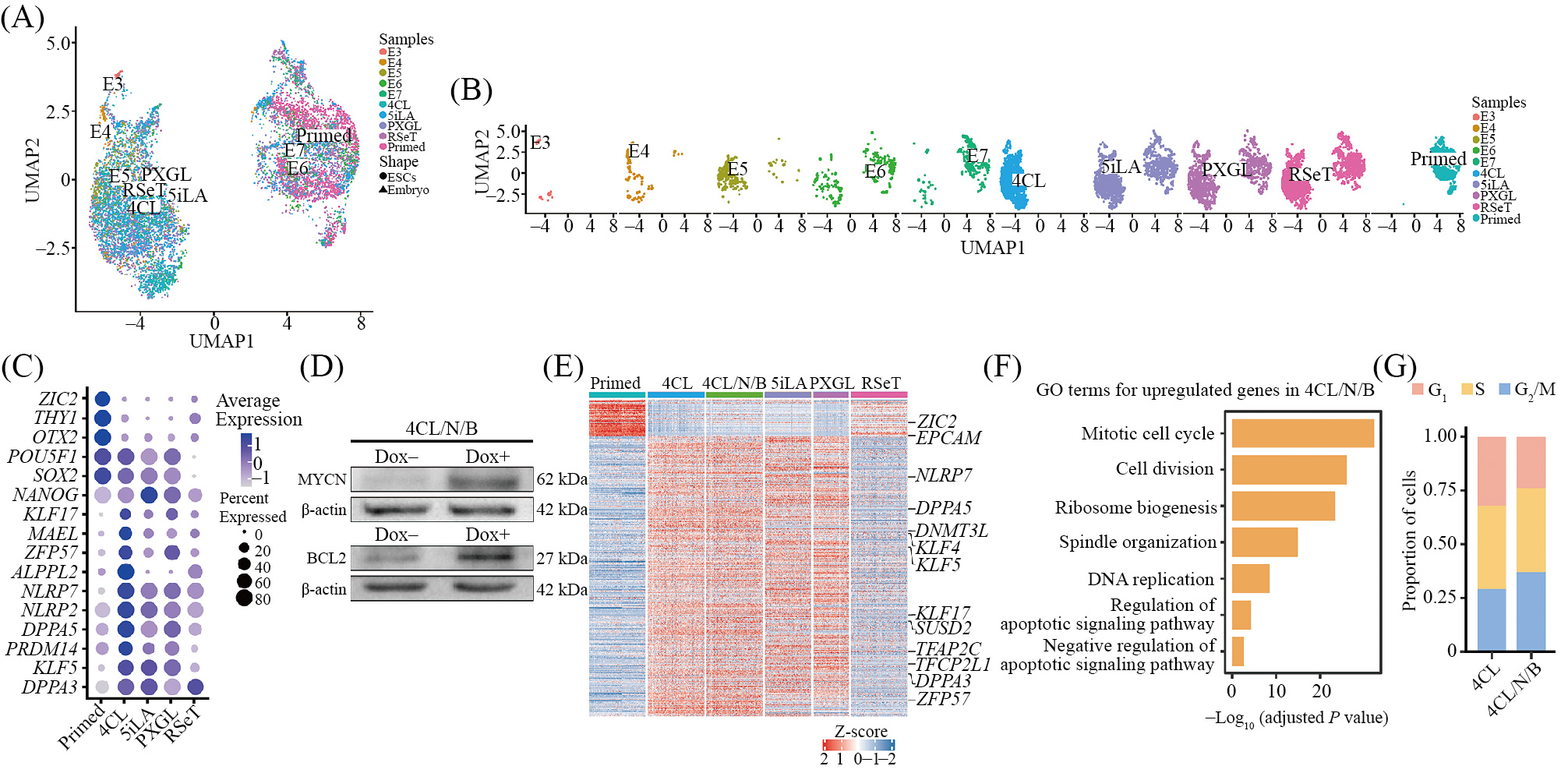
A、B: 基于scRNA-seq数据, 利用UMAP降维对4CL、5iLA、PXGL、RSeT培养基培养的naïve细胞及primed细胞与不同时期人植入前胚胎进行聚类分析; C: 基于scRNA-seq数据, 分析利用4CL、5iLA、PXGL、RSeT培养基培养获得的naïve细胞, 及primed细胞中的多能性相关基因表达情况;D: Western blot检测4CL/N/B细胞中MYCN、BCL2的表达情况; E: 基于scRNA-seq数据分析的4CL、4CL/N/B、5iLA、PXGL、RSeT和primedPSC间差异基因表达情况热图; F: GO分析显示4CL/N/B细胞中细胞周期、细胞通路等相关基因上调; G: 与4CL培养的naïve细胞相比, 4CL/N/B细胞处于G2/M期的细胞比例更高。
A,B: UMAP comparing scRNA-seq datasets of the human preimplantation embryos with human PSCs cultured in 4CL, 5iLA, PXGL, RSeT and primedconditions; C: the expression patterns of pluripotency-related genes based on scRNA-seq datasets of human PSCs cultured in 4CL, 5iLA, PXGL, RSeTand primed conditions; D: Western blot of MYCN and BCL2 expression in 4CL/N/B iPSCs with or without Dox induction; E: heatmap of differentiallyexpressed genes (DEGs) among 4CL, 4CL/N/B, 5iLA, PXGL, RSeT, and primed PSCs based on scRNA-seq datasets; F: GO analysis showed cellcycle, cell pathway and other related genes were upregulated in 4CL/N/B cells; G: 4CL/N/B cells had a higher proportion of cells in the G2/M phasecomparing to 4CL cultured naïve cells.
图1 scRNA-seq数据表明4CL/N/B细胞为早期胚胎样细胞并具有较强的增殖能力(根据参考文献[21]修改)
Fig.1 scRNA-seq datasets indicate that 4CL/N/B cells exhibit characteristics of early embryonic-like cellsand possess strong proliferative capacity (modified from reference [21])
3 胚胎补偿技术体系的优化
嵌合胚胎在体外培养至囊胚阶段再进行移植,在体外培养期间, 异种嵌合胚胎的培养基同时影响着猪胚胎及人源供体细胞的发育。为此, 我们分别尝试应用猪胚胎培养基PZM、人源细胞培养基4CL以及PZM与4CL等比例混合培养基(PZM׃4CL=1׃1(对猪孤雌胚胎进行培养, 并依照胚胎补偿的技术流程, 分别选取4-8细胞期及桑葚胚期的孤雌胚胎进行测试。结果显示, 在单独应用4CL培养基培养4-8细胞期的猪胚胎时, 猪胚胎发育发生严重阻滞, 在E6.5没有获得胚胎。而应用等比例混合培养基培养的4-8细胞猪胚胎的囊胚率有所提高, 但也仅为30%。对于桑葚胚组而言, 利用4CL培养的猪胚胎, 其胚胎发育率相较于PZM组仍然较低, 但利用等比例混合培养基培养的猪胚胎, 其胚胎发育率已可达90%以上,基本接近PZM培养体系中的正常胚胎发育水平(图2A和图2B)。这说明PZM׃4CL=1׃1混合培养基可以中和单独4CL培养基对猪胚胎发育的影响。
为了进一步探索PZM׃4CL=1׃1培养体系是否适合用于嵌合胚胎的体外培养, 我们在桑葚胚时期对孤雌胚胎进行了人源供体细胞的注射 , 之后利用PZM及PZM׃4CL=1׃1培养基对嵌合胚胎进行培养。体视荧光观察结合免疫荧光染色结果显示, 利用PZM培养基培养的嵌合胚胎中DsRed阳性细胞数量极少。而从PZM׃4CL=1׃1培养体系中得到的嵌合胚胎囊胚率大大高于PZM(图2C)。因而我们后续将应用PZM׃4CL=1׃1的混合培养基对嵌合胚胎进行培养。
人源细胞的注射数目也是影响嵌合效率以及胚胎发育率的重要因素之一。为此, 我们也对人源细胞初始注射数量进行了摸索。起初, 我们依据已报道的啮齿类动物的相关研究数据, 向孤雌猪胚胎中注射7~10个人源供体细胞。我们发现人源供体干细胞数量过多时, 大量嵌合重构胚胎会出现发育异常停滞, 嵌合胚胎的囊胚发育率会严重下降。之后, 我们将注射数目控制在3~5个, 在此情况下, 多数胚胎可以正常发育并能够获得更多阳性嵌合胚胎(图2D)。
综合上述结果, 我们优化了适用于构建人–猪嵌合胚胎的胚胎补偿技术体系, 并将基于这套技术体系, 结合4CL/N/B细胞进行接下来的研究。
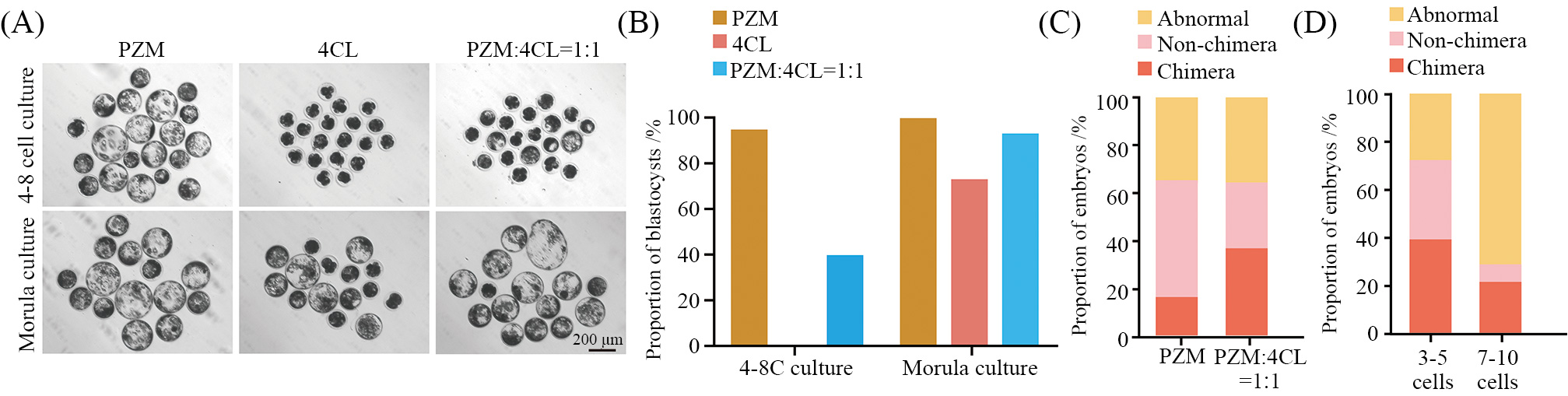
A: 4-8细胞期及桑葚期胚胎在不同培养体系下培养至囊胚阶段(E6.5)的照片; B: 4-8细胞期及桑葚期胚胎在不同培养体系下的囊胚率统计; C: 不同培养体系下培养桑葚期人–猪嵌合胚胎最终获得的嵌合囊胚、未嵌合囊胚以及非正常囊胚数目的比例统计; D: 注射不同人源供体细胞数目的人–猪嵌合胚胎最终获得嵌合囊胚、未嵌合囊胚以及非正常囊胚数目的比例统计。
A: representative bright field images of 4-8 cell stage and morula stage cultured to E6.5 pig blastocysts under different culture conditions; B: quantification of blastocyst formation proportion in the conditions from panel A; C: proportional statistics of the number of chimera, non-chimera, and abnormalblastocysts obtained from the culture of human-pig chimeric morula-stage morula-stage embryos in different culture systems; D: proportional statisticsof the number of chimera, non-chimera, and abnormal blastocysts obtained from human-pig chimeric embryos injected with different numbers of human donor cells.
图2 人–猪胚胎补偿技术体系的优化(根据参考文献[21]修改)
Fig.2 Optimization of human-pig embryo complementation technology system (modified from reference [21])
4 4CL/N/B细胞在体外宿主猪胚胎中的嵌合情况分析
如上文所述, 人源供体细胞早期在异种胚胎内会发生严重的凋亡进而影响嵌合效率。为了评估4CL/N/B细胞在异种猪胚胎中的抗凋亡能力及存活情况。我们将Dox诱导后的4CL/N/B细胞注射到猪孤雌胚胎内, 之后通过TUNEL及Annexin V凋亡试剂对发育至囊胚的嵌合重构胚胎进行染色, 从而检测4CL/N/B是否发生凋亡。结果显示, 重构胚胎内只有极少的4CL/N/B细胞表现为TUNEL阳性, 且未见明显Annexin V阳性4CL/N/B细胞(图3A)。这表明4CL/N/B具有较强的抗凋亡能力。接下来, 我们对嵌合胚胎中的4CL/N/B细胞是否与猪细胞建立细胞间连接进行检测。通过对细胞间黏附分子E-cadherin进行免疫荧光染色发现, 4CL/N/B细胞与猪细胞间产生很好的连接(图3B)。同时, 我们针对存活的4CL/N/B细胞是否能够与猪细胞之间存在有效的功能性连接进行了进一步检测。我们预先用钙黄素(Calcein AM)和Dil染色剂对4CL/N/B细胞进行孵育。将处理过的细胞注入到猪桑葚胚中, 24 h后对重构胚胎进行荧光检测。当细胞间建立有效连接时, 钙黄素能够通过细胞间隙扩散, 而对于活细胞而言, Dil染料不会扩散,因此我们将Dil作为对照, 排除因4CL/N/B细胞凋亡导致的染料泄漏。通过体视荧光检测, 我们发现嵌合胚胎中钙黄素能够从4CL/N/B细胞扩散至邻近的猪细胞中, 而Dil未出现泄漏(图3C)。这说明4CL/N/B细胞不仅能够在胚胎中高效存活, 并可与猪供体细胞建立有效的功能性连接, 进行分子或信号交流。
接下来, 为了评估猪胚胎中4CL/N/B细胞的发育潜能 , 我们对嵌合胚胎的 SOX2及 CDX2进行免疫荧光。SOX2是调控细胞多能性的主要转录调控因子, 也被认为是内细胞团(inner cell mass, ICM)的典型marker基因。转录因子CDX2则是滋养外胚层(trophectoderm, TE)的主要调节分子之一, 鉴于滋养层将在哺乳动物发育过程中形成胎盘及卵黄囊等胚外组织, 因此CDX2可用于指示滋养外胚层细胞。我们注意到, 一些接近内细胞团的4CL/N/B细胞表达SOX2, 并且4CL/N/B细胞也会分布到滋养层中表达CDX2(图3D和图3E), 说明4CL/N/B细胞能够伴随胚胎发育贡献到猪内细胞团和滋养层中, 并有能力参与胎儿、胎盘及卵黄囊的形成。
上述体外胚胎水平的实验结果显示4CL/N/B细胞可在人–猪嵌合胚胎中存活、增殖, 同时与宿主细胞建立功能连接, 并伴随胚胎发育分化为胚内和胚外谱系细胞。这说明我们构建的4CL/N/B细胞是一种具有高分化潜能、强增殖及抗凋亡能力的人多能干细胞, 是可用于进行肾脏异种体内再造的理想人源供体细胞。
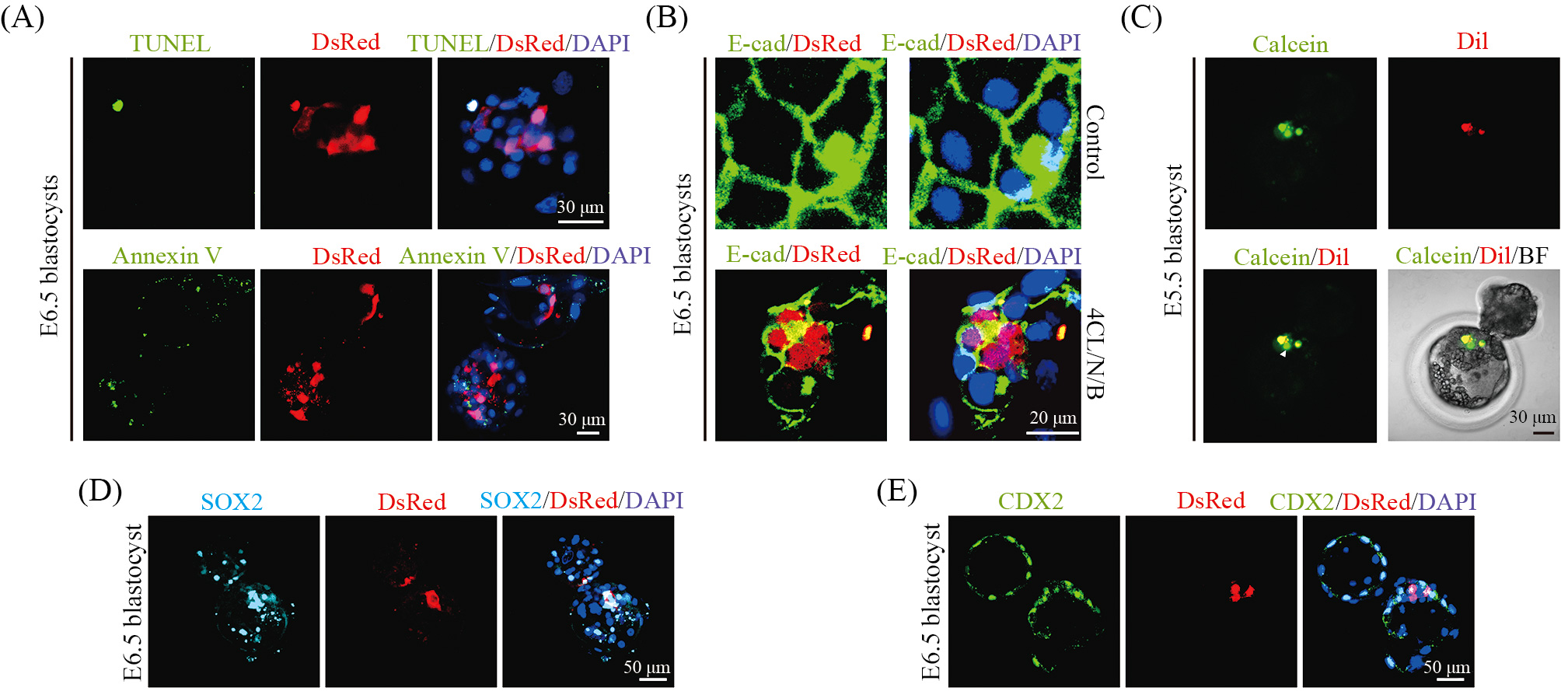
A: TUNEL及Annexin V染色指示4CL/N/B细胞在嵌合囊胚中无明显凋亡情况; B: E-cadherin染色显示4CL/N/B细胞与猪细胞产生黏附; C: calcein染色剂指示4CL/N/B细胞与猪细胞建立功能连接; D: SOX2免疫荧光染色指示4CL/N/B细胞可分化成为内细胞团细胞; E: CDX2免疫荧光染色指示4CL/N/B细胞可分化成为滋养外胚层细胞。
A: TUNEL and Annexin V staining indicated that 4CL/N/B cells had no significant apoptosis in chimeric blastocysts; B: E-cadherin staining showed adhesion of 4CL/N/B cells to pig cells; C: calcein stain indicated the establishment of functional connections between 4CL/N/B cells and pig cells; D: SOX2immunofluorescence staining indicated that 4CL/N/B cells could contribute to ICM; E: CDX2 immunofluorescence staining indicated that 4CL/N/B cellscould contribute to TE.
图3 针对嵌合胚胎中4CL/N/B细胞的存活能力、与宿主间连接及分化潜能的检测(根据参考文献[21]修改)
Fig.3 Detection of the viability, host integration, and differentiation potential of 4CL/N/B cells in chimeric embryos(modified from reference [21])
5 双基因修饰肾脏缺陷猪模型的建立
与其他大多数器官的发育过程不同, 肾脏会经历三个连续的发育阶段[22]。后肾作为哺乳动物永久肾脏, 由输尿管芽和后肾间质相互诱导产生。利用小鼠PSCs在敲除肾脏发育关键基因Sall1的大鼠中虽然成功地再造了小鼠肾脏, 但该异种肾脏中的部分输尿管仍来源于大鼠[3]。这就说明, 单一的肾脏发育关键基因缺失可能不足以构建理想的器官缺陷猪模型。
在先前的研究中, 我们利用CRISPR/Cas9技术成功获得了SIX1–/–阳性猪胎儿成纤维克隆。并利用阳性成纤维克隆结合核移植技术成功构建了SIX1–/–的肾脏缺陷猪模型, 与野生型(wild type, WT)猪胎儿后肾相比, SIX1–/–胎儿的肾脏表现为肾小管严重空泡化变性, 但未出现后肾缺失的表型(图4A和图4B)。在本研究中, 我们首先借助体细胞核移植技术, 利用分离获得的SIX1–/–原代猪胎儿成纤维细胞构建了克隆胚胎。之后对1细胞期的克隆胚胎注射靶向SALL1的sgRNA和胞嘧啶碱基编辑器(cytosine base editor, CBE)的mRNA(CBE通过将胞嘧啶脱氨变为尿嘧啶, 进而对应胸腺嘧啶, 从而将sgRNA中谷氨酰胺CAA变为终止密码子TAA, 提前终止突变SALL1基因)。之后, 我们将注射了mRNA的重构胚胎移植到代孕母猪体内,并在E35剖取猪胎儿(图4C)。H&E染色结果显示, 与对照胎儿相比, SIX1/SALL1双基因纯合敲除胎儿表现出明显的中肾发育缺陷(中肾尾部的小管数目大量减少)及后肾的完全缺失(图4D)。鉴于该双基因敲除猪模型理论上可为人源供体细胞提供更为充足的器官生态位空缺, 我们将在后续以此模型为载体, 进行人源肾脏异种体内再造的研究。
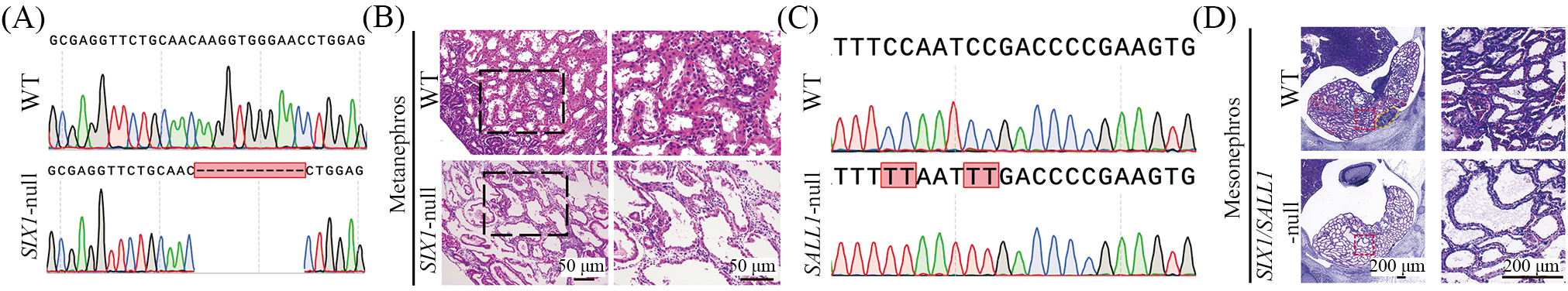
A: SIX1–/–胎儿基因型sanger测序峰图; B: H&E染色显示E51 SIX1–/–胎儿后肾肾小管空泡化变性; C: 双基因纯合敲除胎儿的SALL1基因sanger测序峰图; D: WT与SIX1/SALL1双基因敲除E35胎儿肾脏部位H&E染色, 右侧为胎儿中肾局部放大, 黄色虚线圈出位置为后肾部位。
A: sanger sequencing chromatograms of SIX1–/– fetuses; B: H&E staining showed vacuolar degeneration of E51 SIX1–/– renal tubules; C: sanger sequencing chromatograms of SALL1 gene in double-gene homozygous knockout embryo; D: H&E staining images of mesonephros in WT and SIX1/SALL1-null embryos at E35. The right side was the local enlargement of the mesonephros and the yellow dotted line in the WT embryo delineated the metanephros.
图4 肾脏缺陷猪胎儿的基因型检测及表型分析(根据参考文献[21]修改)
Fig.4 Genotype detection and phenotype analysis of nephric-defective pig fetuses (modified from reference [21])
6 基于胚胎补偿技术在猪体内再造人源中肾
如上所述, 我们已经获得了新型人源供体干细胞4CL/N/B以及多基因修饰的肾脏缺陷猪模型。接下来我们将基于二者, 利用优化的胚胎补偿技术体系, 尝试在肾脏缺陷猪模型体内再造人源肾脏器官。依据上述方案构建SIX1及SALL1双基因敲除的核移植胚胎。待重构胚胎发育到桑葚胚时期, 依据优化的胚胎补偿技术体系向其中注射3~5个DsRed荧光蛋白标记的4CL/N/B细胞。24 h后, 我们将含有红色荧光的阳性囊胚移植到代孕母猪体内。移植两周后,对代孕母猪进行B超检测。对于确定怀孕的代孕母猪, 分别在E25和E28终止妊娠, 并剖取胎儿。我们最终获得E25嵌合胎儿2只, E28嵌合胎儿3只。在体式荧光镜下, 我们可在嵌合胎儿的中肾部位观察到明显的红色荧光。通过进一步的免疫荧光染色检测, 我们发现这些嵌合胎儿的中肾内均存在大量的DsRed阳性人源细胞, 并且这些人源细胞参与了中肾小管的形成(图5A)。我们对含有人源细胞的中肾小管在中肾内所占的比例进行统计, 其占比为38%~58%(图5B)。为了进一步验证红色荧光细胞为人源细胞, 我们利用人核特异性抗体(h-nuclei)与DsRed进行免疫荧光共染。结果显示h-nuclei与DsRed蛋白共定位表达, 证明嵌合胎儿中肾内红色荧光细胞确为人源细胞。针对中肾部位DsRed及h-nuclei双荧光细胞的量化统计结果表明, 人源细胞占比为50%~70%(图5C)。同时, 我们也通过组织学染色来检测胎儿的中肾是否结构完整。H&E染色结果显示, 不同于缺陷胎儿的中肾发育缺陷, 嵌合胎儿的中肾具有与WT胎儿相同的致密结构,中肾尾部小管数目较缺陷胎儿明显增多(图5D), 这一结果再次证明, 4CL/N/B细胞可伴随胚胎发育填补肾脏缺陷猪模型的生态位空缺, 并将形成人源中肾小管,进而在其体内参与形成结构相对完整的人源中肾。
在明确 4CL/N/B细胞可在肾脏缺陷猪模型体内支持中肾形成后, 接下来我们希望进一步确定中肾内的4CL/N/B细胞是否能够进一步支持后续的肾脏形成。为此, 我们通过免疫荧光染色检测了人源细胞中肾脏发育功能相关基因的表达情况, 以期验证4CL/N/B细胞是否已在真正意义上转化为肾脏细胞。我们首先针对敲除的SIX1及SALL1基因进行了免疫荧光染色。结果表明, 嵌合胎儿中人源细胞表达的h-nuclei或DsRed能够与SIX1或SALL1共定位,说明中肾内的 4CL/N/B细胞已分化成为能够表达SIX1及SALL1的功能性细胞(图5E和图5F)。同时,我们也对另外两个肾脏早期发育关键功能性基因PAX2和WT1进行了免疫荧光共染。PAX2基因编码的蛋白表达于肾管、中肾小管及后肾间质等部位[23],该基因对肾脏的早期发育至关重要, 其缺陷已被证明会导致中肾小管及后肾发育缺陷。而WT1是间质向上皮细胞转变所必需的关键转录因子, 其缺陷被证明会引起尾部中肾小管发育缺失[24]。针对二者的免疫荧光染色表明, PAX2、WT1同样能够与人源细胞中的h-nuclei共定位。这也能够进一步说明嵌入肾脏缺陷胎儿中肾内的4CL/N/B细胞, 能够分化成为具有肾脏发育功能的细胞, 这也预示着, 其将在胎儿后续发育中支持人源后肾的形成。
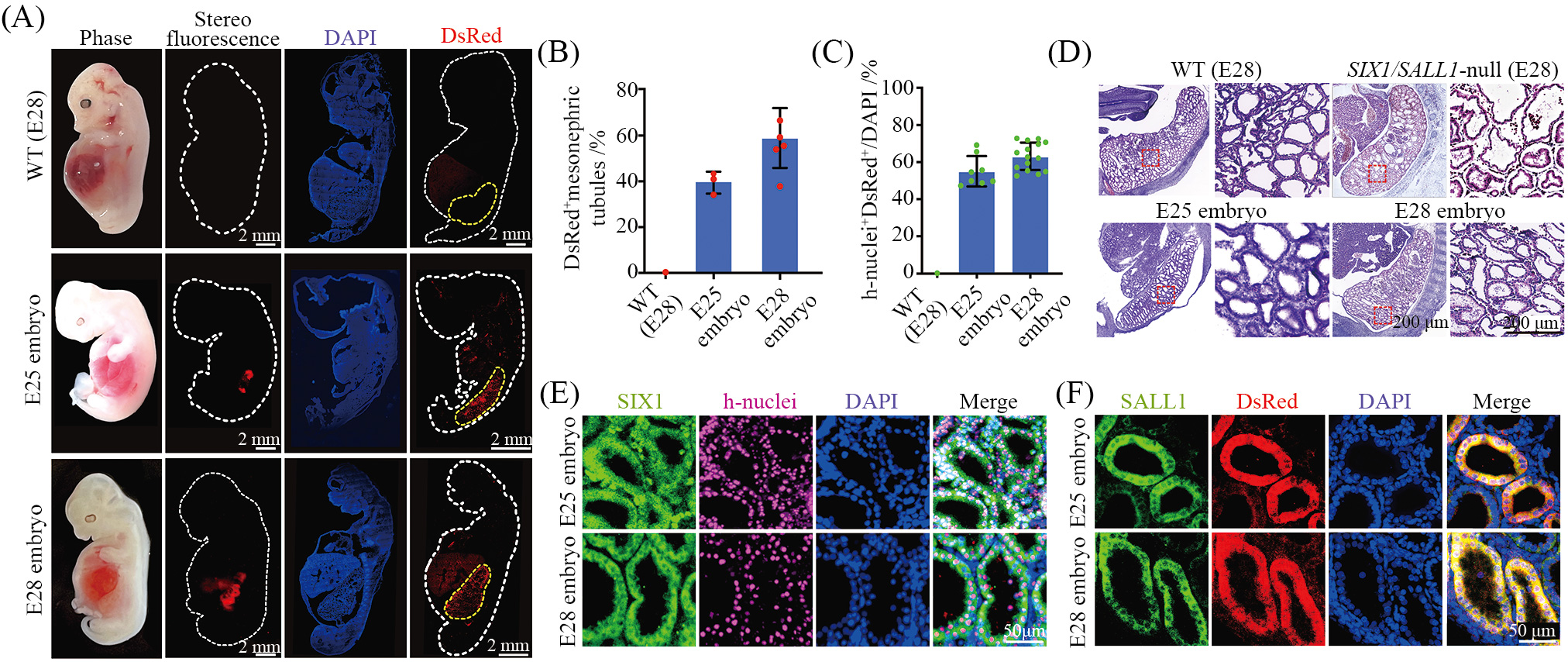
A: WT、E25和E28胎儿明场、体式荧光镜及免疫荧光染色图片; B: WT、E25和E28胎儿DsRed阳性人源中肾小管占比统计; C: WT、E25和E28胎儿中肾内h-nuclei、DsRed双阳性细胞占比统计; D: WT、SIX1/SALL1双基因敲除、E25和E28胎儿中肾区域H&E染色; E: E25和E28胎儿中肾区域SIX1及h-nuclei免疫荧光染色; F: E25和E28胎儿中肾区域SALL1及DsRed免疫荧光染色。
A: representative bright-field, stereo fluorescence and immunofluorescence images of WT, E25, and E28 embryos; B: quantification of DsRed positivemesonephric tubules of WT, E25, and E28 embryos; C: quantification of DsRed and h-nuclei double-positive mesonephric cells of WT, E25, and E28embryos; D: H&E images of mesonephros of WT, SIX1/SALL1-null, E25, and E28 embryos; E: immunofluorescence staining of SIX1 and h-nuclei inmesonephros of E25 and E28 embryos; F: immunofluorescence staining of SALL1 and DsRed in mesonephros of E25 and E28 embryos.
图5 针对嵌合胎儿中人源细胞的嵌合情况进行分析(根据参考文献[21]修改)
Fig.5 Analysis of chimerism of human cells in chimeric embryos (modified from reference [21])
7 总结与展望
基于胚胎补偿技术的器官异种体内再造是再生医学研究的前沿领域。该项技术旨在利用患者自体来源的人多能干细胞, 对器官缺陷大动物模型提供的生态位空缺进行补偿, 进而在异种动物体内再造人源化器官。理论上, 应用这一技术手段获得的再造器官将具有完善的细胞类型、结构及功能, 也可有效避免免疫排斥等诸多问题。因此, 该项技术也被视为用于获取人源化器官, 解决供体器官短缺问题的最具前景途径之一。
在本项工作中, 我们基于具有高分化潜能、强增殖及抗凋亡能力的人多能干细胞4CL/N/B, 优化的胚胎补偿技术体系及多基因修饰的肾脏缺陷猪模型,成功实现了在猪体内再造人源中肾。我们共获得胎龄25天的嵌合胎儿2只, 胎龄28天嵌合胎儿3只。经检测这些嵌合胎儿中肾内人源细胞占比高达70%。在此基础上, 嵌合猪胎儿体内形成了结构完整的人源中肾。更为重要的是, 人源细胞也能够表达多种肾脏发育关键的功能性基因, 说明这些嵌合胎儿体内的人源供体细胞能够分化成为具有支持肾脏发育的功能性细胞, 在条件允许的前提下, 这些细胞将可能伴随着胚胎发育在肾脏缺陷的胎儿体内支持人源后肾的再生。本研究不仅是世界范围内首次成功实现的人源功能性实质器官异种体内再造, 也首次证明了借助胚胎补偿技术实现功能性实质器官异种体内再造的可行性。这一重要突破将为器官异种体内再造奠定重要的理论及技术基础, 也势必将对未来解决供体器官短缺这一世界级难题具有重要价值。
参考文献 (References)
[1] WU J, GREELY H T, JAENISCH R, et al. Stem cells and interspecies chimaeras [J]. Nature, 2016, 540(7631): 51-9.
[2] CRANE A T, ARAVALLI R N, ASAKURA A, et al. Interspeciesorganogenesis for human transplantation [J]. Cell Transplant, 2019,28(9/10): 1091-105.
[3] GOTO T, HARA H, SANBO M, et al. Generation of pluripotentstem cell-derived mouse kidneys in Sall1-targeted anephric rats [J].Nature Commun, 2019, 10: 9.
[4] RASHID T, KOBAYASHI T, NAKAUCHI H. Revisiting the flightof Icarus: making human organs from PSCs with large animal chimeras [J]. Cell Stem Cell, 2014, 15(4): 406-9.[5] NIU D, MA X, YUAN T, et al. Porcine genome engineering forxenotransplantation [J]. Adv Drug Deliv Rev, 2021, 168: 229-45.
[6] LUNNEY J K, VAN GOOR A, WALKER K E, et al. Importanceof the pig as a human biomedical model [J]. Sci Transl Med, 2021,13(621): eabd5758.
[7] XIE J, GE W, LI N, et al. Efficient base editing for multiple genesand loci in pigs using base editors [J]. Nature Commun, 2019,10(1): 2852.
[8] DAS S, KOYANO-NAKAGAWA N, GAFNI O, et al. Generationof human endothelium in pig embryos deficient in ETV2 [J]. NatBiotechnol, 2020, 38(3): 297-302.
[9] MAENG G, DAS S, GREISING S M, et al. Humanized skeletalmuscle in MYF5/MYOD/MYF6-null pig embryos [J]. Nat BiomedEng, 2021, 5(8): 805-14.
[10] ZHENG C, BALLARD E B, WU J. The road to generating transplantable organs: from blastocyst complementation to interspecieschimeras [J]. Development, 2021, 148(12): dev195792.
[11] DE LOS ANGELES A, WU J. New concepts for generating interspecies chimeras using human pluripotent stem cells [J]. ProteinCell, 2022, 13(4): 234-8.
[12] NICHOLS J, SMITH A. Naive and primed pluripotent states [J].Cell Stem Cell, 2009, 4(6): 487-92.
[13] LIU X, OUYANG J F, ROSSELLO F J, et al. Reprogrammingroadmap reveals route to human induced trophoblast stem cells [J].Nature, 2020, 586(7827): 101-7.
[14] GUO G, STIRPARO G G, STRAWBRIDGE S E, et al. Humannaive epiblast cells possess unrestricted lineage potential [J]. CellStem Cell, 2021, 28(6): 1040-56,e1046.
[15] YU L, WEI Y, DUAN J, et al. Blastocyst-like structures generatedfrom human pluripotent stem cells [J]. Nature, 2021, 591(7851):620-6.
[16] PETROPOULOS S, EDSGARD D, REINIUS B, et al. Single-cellRNA-seq reveals lineage and X chromosome dynamics in humanpreimplantation embryos [J]. Cell, 2016, 165(4): 1012-26.
[17] MASAKI H, KATO-ITOH M, TAKAHASHI Y, et al. Inhibitionof apoptosis overcomes stage-related compatibility barriers to chimera formation in mouse embryos [J]. Cell Stem Cell, 2016, 19(5):587-92.
[18] WANG X, LI T, CUI T, et al. Human embryonic stem cells contribute to embryonic and extraembryonic lineages in mouse embryosupon inhibition of apoptosis [J]. Cell Res, 2018, 28(1): 126-9.
[19] ZHENG C, HU Y, SAKURAI M, et al. Cell competition constitutes a barrier for interspecies chimerism [J]. Nature, 2021,592(7853): 272-6.
[20] ZHU Y, ZHANG Z, FAN N, et al. Generating functional cellsthrough enhanced interspecies chimerism with human pluripotentstem cells [J]. Stem Cell Reports, 2022, 17(5): 1059-69.
[21] WANG J, XIE W, LI N, et al. Generation of a humanized mesonephros in pigs from induced pluripotent stem cells via embryocomplementation [J]. Cell Stem Cell, 2023, 30(9): 1235-45,e1236.[22] MCMAHON A P. Development of the mammalian kidney [J].Curr Top Dev Biol, 2016, 117: 31-64.
[23] DRESSLER G R, DEUTSCH U, CHOWDHURY K, et al. Pax2,a new murine paired-box-containing gene and its expression in thedeveloping excretory system [J]. Development, 1990, 109(4): 787-95.
[24] SAINIO K, HELLSTEDT P, KREIDBERG J A, et al. Differentialregulation of two sets of mesonephric tubules by WT-1 [J]. Development, 1997, 124(7): 1293-9.



 中文版
中文版 英文版
英文版